高考专题复习-无机物的推断及检验测试(二)
一、选择题(每小题4分共32分,每小题只有一个选项符合题意)
1.下列关于砷(As)的叙述中,正确的是( )
A.在AsCl3分子中,砷原子量外层电子数为8
B.砷的相对原子质量为74.92,由此可知砷原子核内有42个中子
C.砷的氧化物的化学式为AsH3,它是一种强氧化剂
D.砷酸(H3AsO4)是强酸,其酸性与硫酸相仿
2.在F、P、Si、Fe这四种元素中,每种元素都有某些方面区别于其它三种元素。若从中选出氟元素,选择的理由中正确的是( )
A.最高价氧化物对应水化物酸性最强
B.单质与冷水反应最强烈
C.单质固态时分子晶体,溶沸点较低
D.在氧化物OF6、P2O5、SiO2、Fe2O3中,OF6最稳定
3.下列中的“黄色”不属于化学反应而产生的现象是( )
A.无色试剂瓶中的浓硝酸呈黄色
B.用玻璃片靠近在玻璃导管口燃着的硫化氢的火焰,玻璃片附有的固体呈黄色
C.久置的碘化钾溶液呈黄色
D.单质硫置于水中振荡后静置,沉淀物呈淡黄色
4.某金属与稀硝酸恰好完全反应生成NO,消耗金属和硝酸的物质的量之比为1∶3,则该金属可能是( )
A.Cu B.Ag C.Al D.Fe
5.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是( )
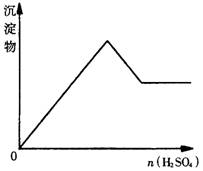
A.NaAlO2与Na2S2O3的混合溶液 B.Na2SiO3与Na2CO3的混合溶液
C.AlCl3与CuSO4的混合溶液 D.Na2SO3与Na2S的混合溶液
6.氯仿(CHCl3)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物(COCl2 )(光气)和氯化氢,为了防止事故发生,在使用前要检查氯仿是否变质,应选用的检查试 剂是( )
A.H2O B.AgNO3溶液 C.NaOH溶液 D.KI溶液
7.向某无色溶液中逐滴加入稀氨水,开始产生沉淀,继续滴加时沉淀逐渐消失,仍得无色溶液。则原溶液可能是( )
A.AlCl3溶液 B.AgNO3溶液 C.NaAlO2溶液 D.BaCl2溶液
8.某种干燥粉末混合物可能由Na2O,Na2CO3,Na2O2,NaCl,NaHCO3中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是( )
A.一定含有Na2O,Na2O2,NaHCO3 B.一定含有Na2O和NaCl
C.不含有Na2CO3,Na2O2 D.不含有Na2CO3,NaHCO3
二、选择题(每小题4分共40分,每小题有一到二个选项符合题意)
9.将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量稀H2SO4, 得到标准状况下的气体11.2L,则原混合物可能的组成是(n代表物质的量)( )
A.n(Fe)<n(S),总质量等于44g B.n(Fe)>n(S),总质量等 于44g
C.n(Fe)=n(S),总质量大于44g D.n(Fe)>n(S),总质量小 于44g
10.A、B两个烧杯中分别盛有100mL 3.0 mol/L的盐酸和NaOH溶液,向两个烧杯中分别 加入等质量的Al粉,在相同状况下产生气体的体积比A∶B=2∶5,则加入Al粉的质量为( )
A.8.1g B.6.75g C.5.4g D.2.7g
11.下列各组物质的溶液相互反应,无论前者逐滴滴入后者,还是后者逐滴滴入前者, 反应现象均相同的是( )
A.HCl和NaAlO2 B.Ca(HCO3)2和Ca(OH)2
C.AgNO3和NH3·H2O D.NaHCO3和HCl
12.在相同条件下,把Zn、Fe、Al分别投入到质量相等的足量稀H2SO4中,反应结束后三种溶液的质量仍相等,则投入的Zn、Fe、Al三种金属的质量关系是( )
A.Al>Fe>Zn B.Fe>Al>Zn C.Al>Zn>Fe D.Zn> Fe>Al
13.钡和钠相似,也能形成含O![]() 离子的过氧化物,下列叙述中正确的是( )
离子的过氧化物,下列叙述中正确的是( )
A.过氧化钡的化学式是Ba2O2
B.1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气
C.O22-离子的电子式为![]()
D.过氧化钠或过氧化钡都是强氧化剂
14.有一种混合气体,它可能由CO、CO2、SO2、HCl中的一种或多种气体组成。该气体依次通过下列物质的现象如下;通过澄清石灰水无白色沉淀析出;通过品红溶液,溶液红色褪去;通过炽热的CuO,固体变为红色;通过澄清石灰水,出现白色沉淀。该混合气体组成的各说法中,正确的是( )
A.肯定不含有CO2 B.只含有SO2和CO
C.含有SO2、CO和CO2,可能含HCl D.含HCl、SO2和CO,可能含CO2
15.为了确定某物质是否被部分氧化,所选试剂不合适的是(括县内为所选试剂)( )
A.K2SO4(BaCl2) B.FeCl2(KSCN)
C.KI(淀粉溶液) D.白磷(紫色石蓝试液)
16.某K2CO3样品中含有Na2CO3、KNO3、Ba(NO3)2三种杂质中的一种 或二种。现将13.8g样品加入足量水,样品全部溶解,再加过量的CaCl2溶液,得到9g沉淀 ,对样品所含杂质的正确判断是( )
A.肯定有KNO3,肯定没有NA2CO3 B.肯定有KNO3,可能还有NA2CO3
C.肯定没有Ba(NO3)2 D.肯定没有Na2CO3和Ba(NO3)2
17.能将Ca(OH)2、K2S、NaCl和Na2CO3四种溶液作出鉴别的试剂是( )
A.NaHCO3 B.HNO3 C.MgCl2 D.H3PO4
18.某无色溶液可能有Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成,该溶液中加入NaOH溶液出现白色沉淀,加入稀H2SO4,也出现白色沉淀并放出气体,则下列判断中正确的是( )
A.肯定有BaCl2 B.肯定有MgCl2
C.肯定无NaHCO3 D.Na2CO3、NaHCO3至少存在一种
三、(本题包括2小题,共19分)
19.(9分)已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光,在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与氢气之密度比约为8.5。
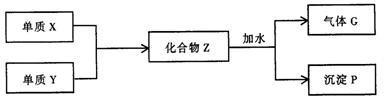
(1)组成单质X和Y的元素分别属第________族和第________族。
(2)化合物Z的化学式为________________。
(3)每生成1mol的气体C,同时应得到________mol的沉淀P。
20.(10分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比 分别为:1:1和2:1,且分子中电子总数分别为地和10;B与D能形成一种极易溶于水的碱性 气体X,B与C能形成极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同、Y分子中 的电子数为18,A、B、D形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性;请回答:
(1)元素符号A________、B________、C________、D________。
(2)写出化学方程式:C2和X(过量)反应________________。
(3)B4A3D2的化学式________,其水溶液呈酸性的离子方程式 ________________。
(4)液态X能电离(可根据B2A电离推知),其阴离子电子式___________________。
四、(本题包括2小题,共20分)
21.(8分)下图表示一些常见无机物之间的转化关系:
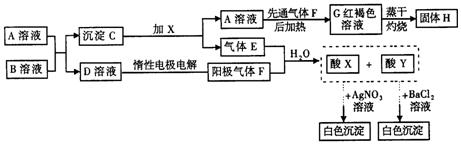
(1)请写出下列物质的化学式:
X________,Y________,H________ 。
(2)E与F等体积混合溶于水生成X+Y的离子方程式为________,A与B反应的离子方程式为________,电解D溶液的离子方程式为______________________。
22.(12分)从物质A的水溶液出发,有下图所示的一系列变化(参加反应或反应生成 的水均略去未表示):
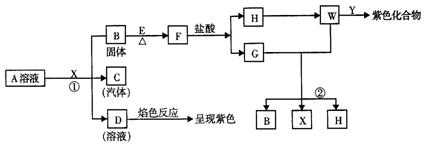
(1)写出下列物质的化学式(有机物写结构简式):
A________,F________,X________ ,Y________。
(2)写出反应①的离子方程式:________________。
(3)写出反应②的化学方程式:________________。
五、(本题包括2小题,共20分)
23.(8分)有关物质有下图所示的转化关系。其中,A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B发生反应②,D的稀溶液与苯酚溶液混合后呈紫色。
据此填空:
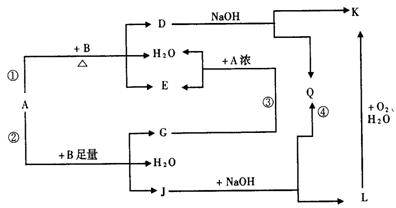
(1)写出下列物质的化学式
A________,D________,E________ 。
(2)反应④的现象是________________;
(3)写出反应②的离子方程式:________________;
(4)A浓溶液与单质B加热时能否产生G?为什么(结合图给信息回答)?
24.(1分)在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 0.255 | 0.385 | 0.459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
试回答:
(1)甲组实验中,盐酸,乙组实验中盐酸(均填“过量”、“适量”或“不足量”)。
(2)要推导出盐酸的物质的量浓度,所提供的数据中作计算依据的是______________,计算出盐酸的物质的量浓度为________mol/L。
(3)要求出合金中镁、铝的物质的量之比,可作计算依据的数据是________________,镁、铝的物质的量之比为________。
(4)在丙组实验之后,向容器中加入一定体积1mol/L的苛性钠溶液,可恰好使铝元素 全部以偏铝酸根形式存在,并使镁离子刚好沉淀完全,则溶液中偏铝酸钠的物质的量为_______mol,氯化钠的物质的量为________mol,所加苛性钠 溶液的体积为________mL。
六、(本题包括2小题,共19分)
25.(9分)已知Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量比为4∶1。现有49.7gCl2,将其通入到足量70℃的NaOH水溶液中,反应完全后得500mL溶液。
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式。
(2)计算完全反应后各生成物的物质的量浓度(除H2O外)。
26.(10分)在密闭容器中使3.62g NaOH、Na2S、Na2SO3的混合物溶于50mL某浓度的稀硫酸中,不放出任何气体,再加入100mL 0.10mol/L的Ba(OH)2溶液,正好中和过量的硫酸,将反应所得沉淀洗净、烘干、称重,其质量为3.29g。求原混合物中各物质的质量。
无机物的推断及检验测试二参考答案
1.A 2.B 3.D 4.D 5.A 6.B 7.B 8.A 9.D 10.B 11.BD 12.A 13.BD 14.D 15.A 16.BC 17.D 18.AB
19.(9分)(1)ⅡA(2分)VA(2分) (2)Mg3N2 (2分) (3)1.5(3分)
20.(10分)(1)O、H、Cl、N(每空1分)
(2)2NH3+3Cl2=N2+6HCl, NH3+HCl=NH4Cl
或8NH3+3Cl2=N2+6NH4Cl。(2分)
(3)H4O3N2(1分)
NH4++H2O![]() NH3·H2O+H+(1分)
NH3·H2O+H+(1分)
(4)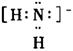 (2分)
(2分)
21.(8分) (1)HCl、H2SO4、Fe2O3
(2)SO2+Cl2+2H2O=4H++SO42-+2Cl-
Fe2++SO32-=FeSO3↓
2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
22.(12分)(1)A:K2S2O3 F:FeS X:HCl Y:![]()
(2)S2O32-+2H+=S↓+SO2↑+H2O
(3)2FeCl3+H2S=S↓+2FeCl2+2HCl
23.(8分)(1)HNO3、Fe(NO3)3、NO2 (每空1分)
(2)白色沉淀变成灰绿色,最终为红褐色沉淀(1分)
(3)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O(1分,未配平,不得分)
(4)不能 (1分),据反应③可知NO遇HNO3(浓)生成NO2。(2分)
24.(12分)
(1)过量,不足量(2分,各1分)
(2)30mL、336mL,l(3分,各1分)
(3)0.255g、280mL,1∶1(3分,各1分)
(4)0.03 0.009 39
提示:溶质为NaCl、NaAlO2
设丙中Mg、Al的物质的量各为x
24x+27x=0.459 x=0.009mol
∵Cl元素守恒 ∴n(NaCl)=n(HCl)=1×0.03=0.03mol (1分)
∵Al元素守恒 ∴n(NaAlO2)=n(Al)=0.009mol (1分)
∵Na元素守恒 ∴V(NaOH)=![]() =0.039L=39ml (2分)
=0.039L=39ml (2分)
25.(9分)
(1)7Cl2+14NaOH![]() 4NaClO+NaClO3+9NaCl+7H2O (2分)
4NaClO+NaClO3+9NaCl+7H2O (2分)
(2)设:49.7gCl2可生成NaClO3物质的量x
7Cl2 ~ NaClO3
7×71g 1mol
49.7g x
x=0.100mol (1分)
c(NaClO3)=![]() =2.00×10-1mol/L (2分)
=2.00×10-1mol/L (2分)
c(NaClO)=2.00×10-1mol/L×4=8.00×10-1mol (2分)
c(NaCl)=2.00×10-1mol/L×9=1.80mol/L (2分)
26.(10分)解:
Ba(OH)2 ~ BaSO4
1mol 233g
0.1mol/L×0.1L ∴2.33g
n(S)=![]() =0.03mol
=0.03mol
n(Na2S)=0.03mol×![]() =0.02mol
=0.02mol
n(Na2SO3)=0.3mol×![]() =0.01mol
=0.01mol
∴m(Na2S)=0.02mol×78g/mol=1.56g
m(Na2SO3)=0.01mol×126g/mol=1.26g
m(NaOH)=3.26g-1.56g-1.26g=0.80g