第一节 重要的氧化剂和还原剂
班级 姓名 学号
1.一定条件下,硝酸铵受热分解的未配平化学方程式为:NH4NO3===HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
A.1∶1 B. 5∶4 C. 5∶3 D.3∶5
2.下列叙述中正确的是
A.元素的单质可由氧化含该元素的化合物来制得
B.失电子越多的还原剂,其还原性就越强
C.阳离子只能得电子被还原,作氧化剂
D.含有最高价元素的化合物一定具有强氧化性
3.根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO
B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO
D.NO>Fe2+>H2SO3>I-
4.G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G→Q+NaCl
![]()
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序为
A.Q、G、Z、Y、X
B. G、Y、Q、Z、X
C. G、Y、Z、Q、X
D. Z、X、G、Y、Q
5.从矿物学资料查得:当胆矾溶液渗入地下,遇黄铁矿(FeS2)时,可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4。下列有关的叙述中正确的是
A.在反应中,FeS2既是氧化剂又是还原剂
B.在反应中,CuSO4是氧化剂,FeS2是还原剂
C.反应中Cu2+与FeS2的物质的量之比是14∶5
D.反应中每生成1molCu2S共得2mol电子
![]() ·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
A.+2价 B.+3价
C.+4价 D.+5价
7.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是
![]()
B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.2Fe2++I2=2Fe3++2I-
8.在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a,b,c,d,e,f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
9.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的反应如下:
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO
下列叙述中正确的是
A.在反应①中,ZnI2既是氧化产物又是还原产物
B.在反应①中,ZnCl2既是氧化产物又是还原产物
C.在反应②中,ICl既是氧化剂又是还原剂
D.在反应②中,Icl既不是氧化剂,又不是还原剂
10.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21∶5 B.4∶1 C.3∶1 D.11∶3
11.实验室将NaClO3和Na2SO3按物质的量之比为2∶1倒入烧杯中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X。反应后,测得NaClO3和Na2SO3正好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
![]()
![]()
![]()
A.+3 B.+5 C.+6 D.+7
13.溴酸钾与溴化钾在酸性溶液中反应,溴元素完全转化成单质溴,反应的离子方程式为______,该反应中,______mol溴酸钾中含有mg溴元素,它能______(填“氧化”或“还原”)______mol的______(填离子或物质名称)。
14.由稀有气体元素Xe(氙)形成的一种化合物XeO3极不稳定。将适量的XeO3投入30mL0.1mol·L-1Mn2+的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56mL。则:
(1)有关反应现象:____________________________________。
(2)若XeO3是分子晶体,写出反应的离子方程式:________________________。
15.A是氮、氢两种元素组成的化合物,它与过氧化氢和水之间在结构上的关系相似。A分子中氮、氢的质量比为7∶1。请填写以下空白。
(1)A的化学式是______。
(2)A在氧化还原反应中也与过氧化氢相似,既可作氧化剂,又可作还原剂。请根据价态分析产生这种情况的原因:____________。
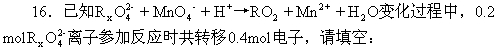
(1)反应的氧化产物为______;
(2)x=______;
(3)参加反应的氢离子的物质的量为______。
17.在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ:2KClO3+2MnO2![]() 2A+B↑+C↑
2A+B↑+C↑
Ⅱ.2A![]() D+MnO2+C↑
D+MnO2+C↑
![]()
(1)反应Ⅰ中氧化产物是(填化学式)____________。
(2)反应Ⅲ的化学方程式为______________________________。
(3)按上述反应过程,若制取1.5mol氧气,总共有______mol电子发生转移。
18.已知在酸性条件下有以下反应关系:
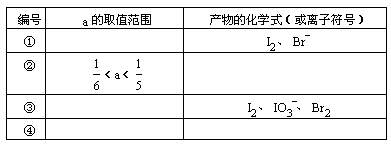
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
现向含有lmolKI的硫酸溶液中加入含a molKBrO3的溶液,a的取值不同,所得产物也不同。
试将讨论的结果填入表中:
19.希尔(Hill R)将分离出的叶绿体加到草酸高铁钾盐溶液中,经过光照以后放出氧气,同时草酸高铁被还原成草酸低铁。
![]()
试回答下列问题:
(1)希尔反应______(填“是”或“不是”)光反应。
(2)希尔实验中每生成1mol氧气,电子转移数目为____________。
(3)希尔实验的主要意义是__________________。
20.目前,科学家致力于研制高效、安全、无毒的饮用水的消毒剂。
(1)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClOH2O+NH2Cl(一氯氨)。NH2Cl较HClO稳定,加液氨能延长液氯杀菌时间的原因是__________________。
(2)科研人员发现在氯消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。世界环保联盟即将全面禁止在自来水中加氯气,推广采用广谱性高效杀菌消毒剂二氧化氯(ClO2,黄绿色气体)。目前欧洲和我国主要采用Kesting法(原料为氯酸钠和盐酸)制ClO2,该法的缺点是同时产生Cl2(占ClO2体积的一半),使产物纯度低。
①试写出该法制ClO2的化学反应方程式:__________________。
②Cl2和ClO2都是通过氧化作用而杀菌消毒,试计算出在同质量时,ClO2的氧化能力是Cl2的_____倍。