高三化学试测题4
本卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共120分,考试时间100分钟。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Cl 35.5 Zn 65
第 Ⅰ 卷
(共两大题,16小题,54分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给一分,选两个且都正确的给3分。但只要选错一个,该小题就为0分)
1、下列物质加入水中显著放热的是
A 固体氢氧化钠 B 生石灰 C 无水乙醇 D 固体硝酸铵
2、下列各组中各有三对物质,它们都能用分液漏斗分离的是
A 乙酸乙酯和水,酒清和水,苯酚和水 B 二溴乙烷和水,溴苯和水,硝基苯和水
C 甘油和水,乙醛和水,乙酸和乙醇 D 油酸和水,甲苯和水,已烷和水
3、将m1g锌加到m2g20%HCl溶液中去,反应结果共放出nL氢气(在标准状况下),则被还原去的HCl的物质的量是
A m1/65mol B 5m2/36.5mol C m2/36.5mol D n/11.2mol
4、 铁棒与石墨棒用导线连接后,浸入0.01mol/L的食盐溶液中,可能出现的现象是
A 铁棒附近产生OH- B 铁棒被腐蚀
C 石墨棒上放出Cl2 D 石墨棒上放出O2
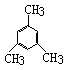
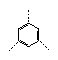
5、 结构不同的二甲基氯苯的数目有
A 4个 B 5个 C 6个 D 7个
6、1体积某有机物的蒸气完全燃烧时需2体积O2,同时产生2体积CO2(同温同压下)该有机物可能是
A 乙烯 B 甲酸甲酯 C 丙二酸 D 乙酸
7、 把70%HNO3(密度为1.40g/cm3)加到等体积的水中,稀释后硝酸溶液中溶质的质量分数是
A 0.35 B <0.35 C >0.35 D ≤0.35
8、 等体积的下列溶液,阴离子的总浓度最大的是
A 0.2mol/LK2S B 0.1mol/Lba(OH)2 C 0.2mol/LNaCl D 0.2mol/L(NH4)2SO4
9、能正确表示下列反应的离子方程式是
A 硫化亚铁跟盐酸的反应:FeS+2H+=Fe2++H2S↑
B 氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
C 钠跟水反应:Na+2H2O=Na++2OH-+H2↑
D 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42- =BaSO4↓
10、室温时某溶液的pH值为1,该溶液中可能大量共存的离子组是
A Zn2+,Cl-,Ba2+,NO3- B Na+,NO3-,K+,CO32-
C K+,SO42-,Na+,AlO2- D Cu2+,NO3-,Al3+,SO42-
二、选择题(本题包括6小题,每小题4分,共24分。每题有一个或两个选项符合题意,正确选项只包括一个选项,多选时,该题为0分;若正确选项包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
11、R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之为5:2,则的值是
A 1 B 2 C 3 D 4
12、用0.01mol/LH2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL。若滴定时终点判断有误差;①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05mL)。则①和②[H+]之比的值是
A 10 B 50 C 5×10 D 104
13、在同温同压下,把等体积的空气和二氧化碳混合,并使之在高温下跟足量的焦炭反应。若氧气和二氧化碳最后全部转化为一氧化碳,则反应后气体中一氧化碳的体积分数约是
A 0.60 B 0.64 C 0.70 D 0.75
14、已知原子量:Li 6.9,Na 23,K 39,Rb 85。今有某碱金属M及其氧化物M2O组成的混合物10.8g,加足量水充分反应后,溶液经蒸发和干燥得固体16g。据此可确定碱金属M是
A Li B Na C K D Rb
15、在一定条件下,全盛氨反应达到平衡后,混合气体中NH3的体积占25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值是
A 1/5 B 1/4 C 1/3 D 1/2
16、CaC2和ZnC2,Al4C3,Mg2C3,Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是
A ZnC2水解生成乙烷(C2H6) B Al4C3水解生成丙炔(C3H4)
C Mg2C3水解生成丙炔(C3H4) D Li2C2水解生成乙烯(C2H4)
第Ⅱ卷
(共四大题,8小题,66分)
三、(本大题共12分)
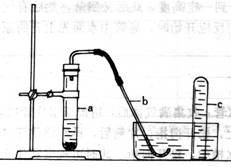 |
17、用示意图中的简易装置可以进行气体的发生和收集。
⑴实验前应如何检查该装置的气密性?答:
⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,逐渐加快。请写出在试管a中所发生的所有反应的化学方程式。答;
⑶从反应中开始到反应结束,预期在试管a中可观察互哪些现象?依次逐一写出。答;
⑷在反应开始时,可观察到导管b中的水面先沿导管b慢慢一升到一定高度,此后又回落,然后有气泡从管回冒出。试说明反应开始时,导管中不面先上升的原因。答:
⑸试管c收集满气体后,用拇指堵住管口,取出水槽。将管口向上,松开拇指,片刻后,再次堵住管口,将试管又再倒置于水槽中,松开拇指,此时可观察到什么现象?答:
四、(本大题共3小题,共20分)
18、(10分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
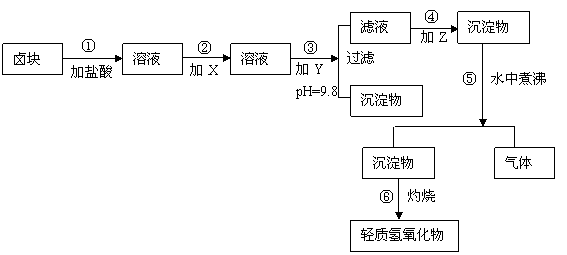
轻质氧化镁工艺流程图
表1 生成氢氧化物沉淀的值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。
表2 化学试剂价格表
| 试剂 | 价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
请填写以下空白:
⑴在步骤②加入试剂X,最付佳选择应是 ,其作用是 。
⑵在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的是 。
⑶在步骤⑤时发生的化学反应方程式是: 。
19、(4分)已知气态氯化铝分子以双聚形式存在,其结构如下图所示:图中“Cl→Al”表示Cl原子提供
|
了一对电子与Al原子共享。又,已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。请写出下面这个方程式右端的两种离子的表达式:
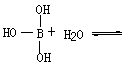 |
+
20、(6分)在某条件下,容器中有如下平衡反应:A+4B≒2C+D+热量 此时A,B,C,的物质的量均为amol,而D的物质的量为dmol。
⑴改变a的取值,再通过改变反应条件,可以使批评重新达到平衡,并限定达到新的平衡时,D的物质量只允许在d/2到2d这间变化,则a的取值范围应是 (用a和d的关系式表示)。
⑵如果要使本反应重新建立和平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)。
A 升高反应温度 B 增大反应容器内之压强 C 增大反应容器容积
D 降低批评温度 E 减小反应容器内之压强 F 减小反应容器容积
五、(本大题共3小题,共24分)
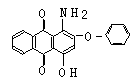
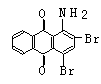
21、(10分)下面是3种有机物的结构式和名称(数字为碳原子编号):
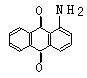 |  | ||||
 | |||||
蒽 醌 1-氨基蒽醌(Ⅰ) 分散红 3B (Ⅱ)
用化合物(Ⅰ)为起始原料,经进3步主要反应可以得到化合物(Ⅱ)。
 |  | ||
![]() (a)
+ Br2
→
+
(a)
+ Br2
→
+
 | |||
 | |||
| |
| |
| |
红棕色
| |
| |

 无色
无色
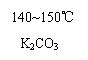 |
| |
| |
| |
| |
⑴请在以上3个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即“系数”)。
⑵从第()步反应的化学原理看,它既发生了取代反应又发生了氧化还原反应。其中氧化剂是 ;配平后的化学方程式中共转移了 电子。
⑶请将反应式()箭号下面的改写在化学方程式的左端,重新另写出它的化学方程式 ,并配平之。
![]() 22、(6分)结构中没有环状的烷烃又名开链烷烃。其分子式通式是CnH2n+2(n是正整数)。分子中每减少2个碳氢键,必然同时会增加1个碳碳键。它可能是重键(双键或三键)也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱度如下:
22、(6分)结构中没有环状的烷烃又名开链烷烃。其分子式通式是CnH2n+2(n是正整数)。分子中每减少2个碳氢键,必然同时会增加1个碳碳键。它可能是重键(双键或三键)也可能是连结成环状烃,都称为增加了1个不饱和度(用希腊字母Ω表示,又名“缺氢指数”)。例如若干烃类分子和烃基的不饱度如下:
① CH3CH2CH3
Ω=0;②(CH3)2CH— Ω=0;③CH2=CHCH2— Ω=1;④
CH3CH2CH3
Ω=0;②(CH3)2CH— Ω=0;③CH2=CHCH2— Ω=1;④
Ω=1;⑤C8H15— Ω=1;⑥ Ω=2;⑦ Ω=2;
⑧CH3C≡CCH2CH=CH2 Ω=3;
![]()
![]() ⑨CH3(CH=CH)3CH3 Ω=3;⑩ Ω=4;⑾
Ω=4;⑿C7H7— Ω=4。
⑨CH3(CH=CH)3CH3 Ω=3;⑩ Ω=4;⑾
Ω=4;⑿C7H7— Ω=4。
 ⑴请写出下列各烃分子的Ω
⑴请写出下列各烃分子的Ω
A B
 C
(立方烷,正立方体的每个顶点上有一个碳原子,每个碳原子上有一个
C
(立方烷,正立方体的每个顶点上有一个碳原子,每个碳原子上有一个
氢原子)
⑵请写出下列烃基的Ω
![]()
D (两价基团)Ω=
 |
E (三价基团)Ω=
F …C≡C… (两价基团)Ω=
 23、(8分)某烃B分子式是C1398H1278。它由4种基团组成,这4种基团分别是:
23、(8分)某烃B分子式是C1398H1278。它由4种基团组成,这4种基团分别是:
(3价) (2价) …C≡C… (2价) (CH3)3… (1价)
已知,该分子结构式中没有发现苯环连接苯环,也没有发现炔键;连接炔键的情况,试求分子中含有这4种基团各几个(请列式求解)
六、(本大题共1小题,10分)
24、(10分)将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热。
⑴可能发生的化学反应有
① Fe+C=Fe+CO↑ ② 2FeO+C=2Fe+CO2↑ ③FeO+CO=Fe+CO2↑
和 ④
⑵若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
⑶若n<4,充分批应后,反应器中的固体物质是 ,气体产物是 。
⑷若反应的气体产物是混合物,n的取值范围是。
⑸若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为 。
高考化学试测题参考答案及评分标准
第Ⅰ卷
一、(每小题3分,共30分)1.A B 2.B D 3.D 4.B 5.C 6.B D 7.C 8.A 9.A 10.A D
二、(每小题4分,共24分)11.B 12.D 13.D 14.B 15.A 16.C
第Ⅱ卷
三、(本大题共12分)
17、(本题共5小,共12分)⑴把导管b的下端浸入水中,用手紧握捂热试管a,导管口会有气泡冒出;松开手后,水又会回升到导管b中(注:未能答全上述3个要点者,不给分)⑵①3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O (1分 )②2NO+O2=2NO2 (1分)
⑶①铜片和稀硝酸反应,有无色气泡产生,反应速度开始缓慢,逐渐加快(注:未注明反应速度由慢变快,不扣分)②试管中的溶液由无色变为浅棕色,又变为无色(注:未注明“又变无色”不给分)③试管中的溶液由无色变成浅蓝色 ④反应结束时,铜片全部反应完
⑷由于反应开始时产生的NO和试管a上部空气中的O2作用生成NO2;NO2易溶于水并与水起反应;使装置内气体的压强暂时减小。所以导管中的水面会先上升到一定高度。(注:未能答全上述3个要点者不给分)⑸①水进入试管,上升到一定高度 (1分)②试管中气体的颜色由棕红色变为无色 (1分)
四、(本大题共3小题,共20分)
18、(10分)⑴漂液(NaClO)。使Fe2+氧化成为Fe3+(或Fe2+→Fe3+)。⑵NaOH。使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便除去。⑶ MgCO3+H2O=Mg(OH)2↓+CO2(每空2分,共10分)
19、(4分)
(负离子也可写成B(OH)4-,正离子也可写成H3O+)
20、(6分)⑴a>4d(3分)⑵d (3分,多选或错选给0分)
五、(本大题共3小题,共24分)
21、(10分)
⑴Ⅰ 1,2,1,2HBr Ⅱ 2,1,1,1Br2,1SO2 Ⅲ 1,1,,1,1
(每个方程式各2分,共6分)
⑵H2SO4 2(每空1分,共2分)⑶(2分)
22、(6分)⑴ (A)4 (B) 7 (C) 5 ⑵ (D) 4 (E) 4 (F) 2
 (每一小题1分,共6分)
(每一小题1分,共6分)
23、(8分)设 、 、…C≡C… 、(CH3)3C…的个数分别为w,x,y,z。
则由C原子数、H原子数、不饱和度数,以及芳环余价应和脂链余价相等4个条件,得4个方程式:C原子数 6w+6x+2y+4z=1398
H原子数 3w+4x+9z=1278
Ω数 4w+4x+2y=![]() =760
=760
余价 3w+2x=2y+z
联立解之,得 w=94 x=33 y=126 z=96 (列式4分,结果4分、共8分)
六、(本大题共1小题,10分)
|
24、⑴C+CO2 = 2CO (2分)
⑵FeO 和Fe,CO (每空1分,共2分) ⑶ C和Fe,CO (每空1分,共2分)
⑷ 1/2<n<1 (2分) ⑸ 2/3 (2分)