高三化学试测题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)共120分,试测时间100分钟。
可能用到的数据:原子量 H 1 C 12 N 14 O 16 Mg 24 S 32
第 Ⅰ 卷
(共三大题,19小题,60分)
一、选择题(每小题2分,共6分,每小题只有一人选项符合题意)
下列1~3小题中都隐含着2个数字,请比较前后这两个数字的大小,A用表示“大于”,B表示“小于”,C表示“等于”,D表示“不能确定”。把答案的序号填写在“答题卷”上。
1、![]() 和
和![]() 原子的中了数
原子的中了数
2、某强酸和某强碱溶液等体积混合后,所得溶液的pH值为7。原酸溶液和原碱溶液的物质的量浓度
3、CH3COOH分别跟![]() 和
和![]() 起酯化反应后,两者生成的水中所含
起酯化反应后,两者生成的水中所含![]() 的质量分数
的质量分数
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两胩且都正确的给3分。但只要选错一个,该小题就为0分)
4、已知氢化锂(LiH)属于离子晶体,LiH跟水反应可以放出氢气,下列叙述中正确的是
A LiH的水溶液呈中性 B LiH是一种强氧化剂
C LiH中的氢离子可以被还原成氢气 D LiH中氢离子与锂离子的核外电子排布相同
5、下列溶液有时呈黄色,其中是由于久置时被空气中氧气氧化而变色的是
A 浓硝酸 B 硫酸亚铁 C 高锰酸钾 D 工业盐酸
6、微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是和,电解质溶液为,电极反应为:Zn+2OH--2e=ZnO+H2O Ag2O+H2O+2e=2Ag+2OH- 总反应为:Ag2O+Zn=2Ag+ZnO 根据上述反应式,判断下列叙述中,正确的是
A 在使用过程中,电池负极区溶液pH值减小
B 在使用过程中,电子由Ag2O极经外电路流向极
C Zn是负极,Ag2O是正极
D Zn电极发生还原反应,Ag2O电极发生氧化反应
7、溴化碘的分子式为IBr,它的化学性质活泼,能跟大多数金属反应,也能跟某些非金属单质反应,它跟水反应的化学方程式为:H2O+IBr=HBr+HIO下列关于溴化碘的叙述中,不正确的是
A 固态IBr是分子晶体
B 把0.1mol/LIBr加入水中配成500mL溶液,所得溶液中Br‑和I-的物质的量浓度均为0.2mol/L
C IBr跟水的反应是一个氧化还原反应 D 在化学反应中,IBr可以作为氧化剂
8、混合相同物质的量浓度的200mLBa(OH)2溶液和150mLNaHCO3溶液,最终所得溶液中各离子物质的量浓度大小顺序为
A [OH-]>[Ba2+]>[Na+]=[HCO32-] B [OH-]>[Ba2+]>[Na+]>[HCO32-]
C [OH-]>[Ba2+]>[Na+]>[CO32-] D [OH-]>[Na+] >[Ba2+]>[CO32-]
9、下列反应的离子方程式正确的是
A 铁跟盐酸反应: 2Fe+6H+ =2Fe2++3H2↑
B 铜跟稀硝酸反应: 3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
C 铜跟氯化铁溶液反应:Cu+2Fe3+=Cu2++2Fe2+
D 碳酸钙跟醋酸:CaCO3+2H+ =Ca2++H2O+CO2↑
10、某一元酸(HA)溶液,加入一种强碱(MOH)溶液,反应后溶液呈中性。下列判断正确的是
A 所用的酸过量 B 生成的盐不水解
C 酸与碱等物质的量混合 D 反应后溶液中[A-]=[M+]
11、将Na2O2投入FeCl2溶液中,可观察到的现象是
A 生成白色沉淀 B 生成红褐色沉淀 C 有气泡产生 D 无变化
根据以下叙述回答12和13题
把0.6molX气体和0.2molY气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g)=nZ(g)+2w(g) 5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速度为0.01mol/L·min,则
12、上述反应中Z气体的计量系数n的值是
A 1 B 2 C 3 D 4
13、上述反应在5min末时,已作用去Y的值占原来量的百分比是
A 20% B 25% C 33% D 50%
三、选择题(本题包括6小题,每小题4分,共24分。每题有一个或两个选项符合题意。若正确选项只包括一个选项,多选时,该题为0分;若正确选项包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分。但只要选错1个,该小题就为0分)
14、某溶液中,由水电离出的[H+]=1×10-12mol/L,则该溶液的pH值可能是
A 12 B 7 C 6 D 2
15、加热碳酸镁和氧化镁的混合物mg,使之完全反应,得剩余物ng,则原混合物中氧化镁的质量分数为
A ![]() B
B ![]() C
C ![]() D
D ![]()
16、某溶液中Cl-、Br-、I‑三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是
A 1:2 B 1:3 C 1:4 D 1:6
17、常温常压下,某容器真空的质量为201.0g,当它盛满甲烷时质量为203.4g,而盛满某气体Y时质量为205.5g,则Y气体可能是
A 氧气 B 氮气 C 乙烷 D 一氧化氮
18、在相同状况下的两杯甲酸溶液,第一杯甲酸溶液的浓度为c1,其电离度为α1;第二杯甲酸溶液的浓度为c2,其电离度为α2。若第二杯甲酸溶液中甲酸根离子的浓度恰为c1,则必然有
A 第一杯溶液的pH值大于第二杯溶液的pH值
B c1>c2 C α1<α2 C α1>α2
19、在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,B中加入稀硫酸。反应完全后,生成氢气的体积分别为V(A)和V(B),而且V(A)≠V(B)。若要确定反应生成物中A和B的化合价,至少还需知道的数据是
A V(A):V(B)的值 B V(A)(或V(B))的值
C A(或B)的物质的量 D 盐酸和硫酸的物质的量浓度
第 Ⅱ 卷
(共四大题,8小题,60分)
四、(本大题共12分)
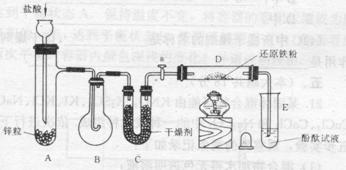 |
20、有下列实验装置
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B;向A中加入一定量浓度适当的盐酸,发生氢气,经必要的“操作”[见问题(2)]后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
⑴实验前如何检查装置的气密性?
⑵点燃氢气闪必须进行 操作,进行该操作的方法是 。
⑶写出B、D中分别发生的化学反应方程式:
B中:
D中:
⑷C中所盛干燥剂的名称是 ;该干燥剂的作用是 。
五、(本大题共18分)
21、某固体混合物可能由KNO3、K2SO4、KI、KCL、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
⑴混合物加水得无色透明溶液;
⑵向上述溶液中滴加BaCl2溶液,有白色沉淀生成。将该沉淀滤出,并将滤液分成两份;
⑶上述白色沉淀可完全溶于稀盐酸;
⑷将两份滤液中的一份,滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
⑸将另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
根据以上实验,可以判断出混合物中肯定含有 ;但不能判断出是否含有 。
22、298K时,合成氨反应的热化学方程式为
N2(g)+3H2(g) ≒ 2NH3(g)+92.4KJ
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是
23、600K时,在容积可变的透明容器中,反应 2HI(g)≒I2(g)+H2(g) 达到平衡状态A。保持温度不变,将容器的容积压缩成为原容积的一半,达到平衡状态B。按图示的观察方向,能否看出两次平衡时容器内颜色深浅的变化?并请说明理由。
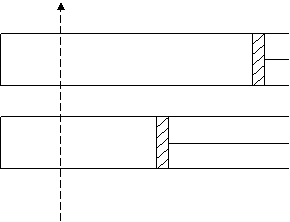 |
平衡状态A
平衡状态B
视线
24、298K时,向VL真空容器内通入n mol SO2和m mol H2S。
⑴若n=2,则当m= 时,反应后容器内气体的密度最小;
⑵若2n>m,则反应后氧化产物与还原产物的质量差为 g;
⑶若5n=m,且反应后氧化产物与还原产物的质量和为48g,则n+m= 。
六、(本题共16分)
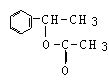
![]() 25、化合物A,学名邻羟基苯甲酸;俗名水杨酸;其结构式如下式所示
25、化合物A,学名邻羟基苯甲酸;俗名水杨酸;其结构式如下式所示
⑴将A跟哪种物质的溶液反应可得到一钠盐(其化学式为C7H5O3Na)?
(A) NaOH (B) Na2S (C) NaHCO3 (D) NaCl
⑵水杨酸的同分异构体中:属于酚类、同时还属于酯类的化合物有 (填数字)种,其结构简式分别为:
⑶水杨酸的同分异构体中:属于酚类,但是不属于酯类、也不属于羧酸类的化合物必定含有 基(填写除了羟基以外的官能团名称)。
26、1mol某烃A,充分燃烧可以得到8molCO2和4molH2O。烃A可通过如下图的各个反应得到各种化合物和聚合物。
![]() CO2+H2O
CO2+H2O
燃烧 Br2—CCl4溶液
![]()
![]()
![]()
![]() C
A
E
C
A
E
![]()
![]()
![]() 浓NaOH醇溶液,△
Zn粉,△
浓NaOH溶液
浓NaOH醇溶液,△
Zn粉,△
浓NaOH溶液
加聚 △
NaOH
溶液, B
![]() 催化剂
F
催化剂
F
![]() D
D
![]() 醋酸酐
Br2—CCl4溶液 Zn粉,△
醋酸酐
Br2—CCl4溶液 Zn粉,△
醋酸
 G
G
(C8H6Br4)
⑴以下11个反应中,属于消去反应的有 (填数字)个。它们分别是:由C→A,
(填写由X→Y)。
⑵化合物的结构简式A是 ,D是 ,E是 ,G 是 。
七、(本题共14分)
27、80℃、101.3kPa下,用下图装置进行如下实验。A、C两筒内分别装有无色气体,它们可能含有NH3、O2、N2、H2S、NO、CO2等气体,B管内装有固体。推动A的活塞使筒中的气体缓缓地全部通过B后进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压下却并末变化。
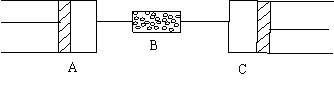
⑴C中发生的反应,其化学方程式是 ,已知原C中的气体是单一气体,它是 (若有多种可能的答案,需一一列出)将反应后C筒中的气体,用水充分吸收,在同温同压下,气体体积减少一半 ,则与水反应前C中的气体是 。(若有多种可能的答案,需一一列出)
⑵若实验开始前A、C中气体的体积(换算成标准状况)分别为1.40L和2.24L,且A中的气体经过B管后,B管增重了1.40g。通过计算和推理可判定A中的气体是,其质量为
g。(不必写出计算和推理过程)
参考答案
第Ⅰ卷
一、(每小题2分,共6分)
1.B 2.D 3.C
二、(每小题3分,共30分)
4.D 5.B 6.AC 7.BC 8.D 9.BC 10.D 11.BC 12.A 13.B
三、(每小题4分,共24分)
14.AD 15.A 16.B 17.CD 18.AD 19.A
第Ⅱ卷
四、(本大题共12分)
20、⑴在A中放入少量水,使水面刚浸没漏斗颈下端,打开旋塞a,在烧瓶B底部稍加热,若在A中漏斗颈骨水面上升,且E中导管口有气泡逸出,表示装置不漏气。(也可以关闭活塞a,用同样的方法分别在烧瓶B底部和反应管D下部稍加热,检查活塞前、后两部分装置是否漏气。两种回答都正确) (2分)
⑵检验氢气纯度 (1分) 用排水法(或向下排气法)收集一试管氢气,用拇指堵住,移近火焰,没有尖锐的爆鸣声,表示氢气纯度合格,可以点燃和收集。 (2分)
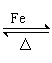 |
|
⑷碱石灰(也可以回答生石灰、氢氧化钠固体、或任意一种碱性固体干燥剂。回答出其中任一种的名称都给分) (2分) 吸收气体中少量的水蒸气和盐酸酸雾。 (2分)
五、(本大题共4小题,共18分)
21、(5分) Na2CO3(2分) KNO3,KCl,NaCl(各1分,共3分)各空位上填对一种物质给1分;多填一种物质扣1分,扣至0分为止。
22、(3分)该反应是可逆反应,在密闭容器中进行将达到平衡,1molN2和1molH2不能完全反应生成2molNH3,因而放出的热量总少于92.4KJ。
23、(3分)可以观察到颜色深浅的变化。(1分)
由于方程式两边气体物质的量相等,容积减半,压强增大到2倍时,I2(g)及其它物质的物质的量均不变。但浓度却增大到2倍,故可以看到I2(g)的紫色加深。(2分)
24、(7分)⑴ 4 (2分) ⑵ 16m (2分) ⑶ 3 (3分)
六、(本大题共16分)
25、(本大题共8分)
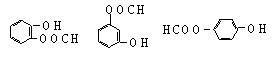 ⑴C(或NaHCO3)(2分)
⑴C(或NaHCO3)(2分)
⑵ 3,
(每项1分、共4分)⑶ 醛基(或—CHO、)(写成—COH、—C—OH均不给分) (2分)
26、(本小题共8分)⑴ 4,E→A、E→F、G→F(每项1分,共4分)⑵A:C6H5CH=CH2 D: E:G:C6H5CBrCHBr2 (每个结构简式各1分,共4分)
七、(本大题共14分)
27、(本大题共14分)⑴ 2NO+O2 =2NO2 (1分) NO(1分) NO和NO2(2分)(此项多写或少写均不给分)
⑵ CO2和O2 (7分)(此项多写或少写均不给分) 2.6 (3分)