高三第五次摸底考试化学试卷
第I卷(选择题,共72分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 P 31 Cl 35.5 Na 23 K 39 Al 27
注意:请将选择题的答案填在答题卡中
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.1993年的世界10大科技新闻称,中国学者徐志傅和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146年氢原子构成。关于此物质,下列说法错误的是
A.属于烃类化合物 B.具有类似金刚石的硬度
C.在常温下呈固态 D.能在空气中燃烧
2. 下列物质水解时最难断裂的化学键是:
3.对复杂的有机物的结构,可以“键线式”简化表示。如有机物CH2=CH—CHO可以简写
|
|
A.6种 B.7种 C.8种 D.9种
4.A、B两个烧杯中分别盛80mL 3.0mol·L-1的盐酸和氢氧化钠溶液,再分别加入等质量的铝粉,在相同状况下产生气体的体积比为A:B=2:5,则加入铝粉的质量为
A.2.7g B.6.48g C.5.4g D.4.05g
5.世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。则二氧化氯
A.是强氧化剂 B.是强还原剂
C.是离子化合物 D.分子中氯为负1价
6.向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是
A.该溶液中一定含有SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
7.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.没有氢键就没有生命
D.H2O是一种非常稳定的化合物,这是由于氢键所致
8.在反应:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4
达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
2Fe(SCN)3+3K2SO4
达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
A.KSCN B.K2SO4 C.NaOH D.FeCl3
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。)
9.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ/mol,Cl—Cl键的键能为243 kJ/mol,H—Cl键的键能为431 kJ/mol,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于
A. -183 kJ·mol—1 B. 183 kJ·mol—1
C. -862 kJ·mol—1 D. 862 kJ·mol—1
10.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
A.Cl-、Mg2+、NO3—、K+ B. HCO3—、K+、NO3—、SO42—
C.SO42—、Cl-、CO32—、Na+ D. NH4+、Cl-、Na+、Ba2+
11.下列说法正确的是
A.53.5gNH4Cl中含有H-Cl键的个数为4NA
B.12g石墨中含有C-C键的个数为4NA
C.12g金刚石中含有C-C键的个数为4NA
D.60gSiO2中含有Si-O键的个数为4NA
12.下列反应的离子方程式正确的是
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S↓+2I-+H+
D.FeBr2溶液与足量Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
13.下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.相同物质的量浓度,相同体积的强酸与强碱溶液混合,反应后pH值一定等于7
C.原子失去电子所形成的离子,不一定具有稀有气体的电子层结构
D.某元素在化学变化中由化合态变为游离态,不能确定该元素一定被还原
14.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于
A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2
15.在密闭容器中加入A、B两种气体,在一定条件下发生如下反应:
![]()
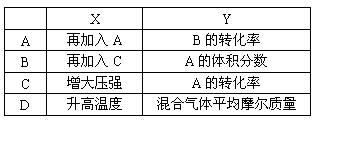 2A(g)+B(g)
2C(g) △H<0
2A(g)+B(g)
2C(g) △H<0
达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是
16.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
17.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的正极连接
18.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为
A.1~2mol之间 B.1~4mol之间 C.2~4mol之间 D.大于4mol
第II卷(非选择题,共78分)
![]() 三、(本题包括2小题,共24分)
三、(本题包括2小题,共24分)
19.(8分)(1)右图是中学化学实验中的一种常用装置,若要在仅盛有少量水的水槽的条件下检查其气密性(不得使用任何导管、橡皮管,且不得拔下橡皮塞等),其操作方法和现象是________________________
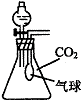 (2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
(2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
①当气球无变化时,锥形瓶中溶质为 ;
②当气球膨胀时,锥形瓶中溶质为 ;
③当气球瘪凹时,锥形瓶中溶质为 。
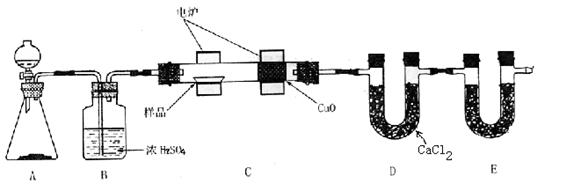 20.(16分)化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
20.(16分)化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
回答下列问题:
①A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式:
。
②C装置(燃烧管)中CuO的作用是 。
③写出E装置中所盛放物质的名称 ,它的作用是 。
④若将B装置去掉会对实验结果造成什么影响? 。
⑤若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为 。
⑥要确定该有机物的化学式,还要 。
四、(本题包括2小题,共16分)
21.(6分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
(1)试写出乙烷气体燃烧的热化学方程式______ __ ___ ____;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是____________________ _。
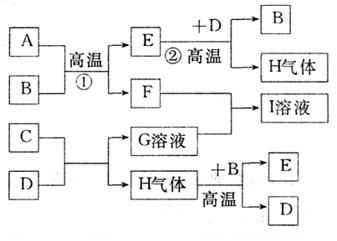
22.(10分)如下图,A、C、E、H是常见单质,B、F是常见氧化物,D是无色液体,I的焰色反应呈黄色。它们之间的转化关系如下图所示:
试回答:(1)写出化学式:B 、C 。
(2)写出反应①②的化学方程式:
① ;
② ;
(3)A与G溶液反应的离子方程式:
|
五、(本题包括2小题,共20分)
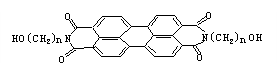
23.(10分)有如下反应ROH+HX![]() RX+H2O。军事上的“地表伪装”是军事上保护的外观色彩、红外反射与环境吻合。BASF是 系新型红外伪装还原染料,为橄榄色或黑色。其化学结构为:
RX+H2O。军事上的“地表伪装”是军事上保护的外观色彩、红外反射与环境吻合。BASF是 系新型红外伪装还原染料,为橄榄色或黑色。其化学结构为:
|
(1)染料BASF的分子式 ;
(2)1mol该物质与Na反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为 , 。
(3)当n=3时,其一氯取代物可能有 种。
(4)和N原子直接相连的C原子 (填能或不能)处于同一平面。
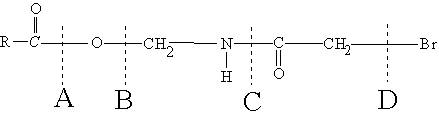
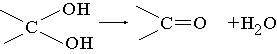
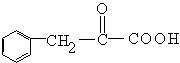
24.(10分)茚是一种碳氢化合物,其结构为 ![]() 。茚有一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键;A能发生如下变化:
。茚有一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键;A能发生如下变化:
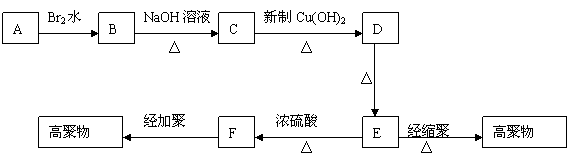 |
已知:多个羟基连在同一个碳上不稳定,易自动失水:
 。若B、C、D、E、F分子中均有一个苯环,试根据变化关系图和已知条件,回答:
。若B、C、D、E、F分子中均有一个苯环,试根据变化关系图和已知条件,回答:
(1) A的结构简式是: D的结构简式是: 。
(2) 写出下列反应的化学方程式:
① E经缩聚生成高聚物: 。
② F经加聚生成高聚物: 。
(3) E到F的有机反应类型是: 。
六、(本题包括2小题,共18分)
25.(10分)现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。
(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的质量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L—1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。(不要求写计算过程)
26.(8分)已知LiI的晶体与NaCl晶体结构相同。实验测得Li+与I—最邻近的距离是0.302nm。假定I—和Li+都是刚性球。
⑴ 欲计算得到I—和Li+的近似半径时,你还必须再作什么假定?
⑵ 计算I—和Li+的近似半径;
⑶ 若用另一种方法测得Li+的半径约为0.060nm~0.068nm,试验证你的假定是否正确。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | D | C | A | B | C | B | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AB | D | C | CD | C | AC | AD | CD | B |
19.(1)将装置倒置使A、B两管都浸入水中,两手紧贴烧瓶外壁,若导管口有气泡出现,把手移开,随后导管A、B中均形成一段水柱,说明装置不漏气。
(2)①Na2CO3 ②Na2CO3与NaHCO3或NaHCO3
![]() ③NaOH与Na2CO3
③NaOH与Na2CO3
20.①H2O2(或双氧水)2 H2O2 2H2O+O2↑
②使有机物充分氧化生成CO2和H2O
③碱石灰或氢氧化钠 吸收CO2气体
④造成测得有机物中含氢量偏高。
⑤CH2O ⑥测出有机物的相对分子质量。
21.(1)2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2O(l);△H= —3119.6kJ/mol
4CO2(g)+6H2O(l);△H= —3119.6kJ/mol
(2)72% (3)烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右
22.(1)Fe3O4、Na
![]() (2)①8Al+3Fe3O4
9Fe+4Al2O3
(2)①8Al+3Fe3O4
9Fe+4Al2O3
②3Fe+4H2O Fe3O4+4H2
③2Al+2OH-+2H2O===2AlO2-+3H2↑
23、(1)C2n+24H4n+10O6N2 (2)1、14 (3)6 (4)能
24、(1)![]()
(2)
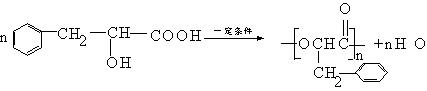
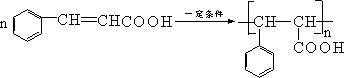
25.(10分)(1)84:100(或21:25) (2)![]() (3)
(3)![]() (4)盐酸的物质的量浓度
(4)盐酸的物质的量浓度
5)![]()
26. 运用假设方法,从复杂的微观体系中抽象出数学模型。欲求得I—和Li+的近似半径,除假设I—和Li+是刚性球外,还需再假定两刚性球间彼此相切,这才将Li+和I—的距离看成是两离子半径之和。
⑵ 根据NaCl的晶体结构可建立如上述的一种“数学模型”。设其中r—表示I—半径,r+表示Li+半径,则有如下关系:
AC = 2(r+ + r—) ①
|
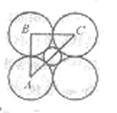
![]() =sin45° ②
=sin45° ②
|
![]() 由①②③式,得: =
0.414 ④
由①②③式,得: =
0.414 ④
又由假定知:r+ + r— = 0.302nm ⑤
④、⑤联立求解r+ = 0.088nm,r—= 0.214nm
⑶ r+>0.060nm~0.068nm,说明可将Li+和I—看成刚性球但实际不相切。因为电子之间互相排斥,致使两离子半径之和小于它们之间的理论距离。