高三第一次联考化学试卷
命题学校:长沙市长郡中学 命题人:姚建民 审题人:翁光龙
说明:本套试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分110分。考试时间:100分钟。
可能用到的相对原子质量:H~1,C~12,N~14,O~16, Na~23,S~32,Cl~35.5,K~39,Fe~56,Cu~64,Zn~65。
第I卷(选择题,请将符合题意的选项填在答题卷的空格里,共55分)
一、选择题(本大题包括5个小题,共10分。每小题只有一个选项符合题意)
1.三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价或再生的水电,相当于每年5000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制: ①氮氧化物的排放 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤白色污染
A.①②④ B. ②④ C. ③④ D.①②⑤
2. 2003年10月15日,我国成功地实现了“神州号”宇宙飞船载人飞行。发射飞船的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体主要是![]() ,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是
,这些气体均为无色,但在卫星发射现场看到火箭喷出大量红烟,产生红烟的原因是
A. 高温下![]() 遇空气生成
遇空气生成![]() B.
NO遇空气生成
B.
NO遇空气生成![]()
C. ![]() 与NO反应生成
与NO反应生成![]() D.
NO与H2O反应生成
D.
NO与H2O反应生成![]()
3.下列物质的水溶液(除水外)中,存在电离平衡的是
A.Ca(OH)2 B. CH3COOH C. BaSO4 D. CH3COONH4
4. “绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤加聚反应 ⑥缩聚反应 ⑦酯化反应
A. ② B. ② ⑦ C. ① ⑥ D. ② ⑤
5. 下列物质一定不是天然高分子化合物的是
A. 淀粉 B. 纤维素 C. 酚醛树脂 D. 蛋白质
二、选择题(本题包括10个小题,共30分。每小题有1~2个选项符合题意)
6. 关于反应K37ClO3+6H35Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
A. KCl中含有35Cl B. KCl中含有37Cl
C. 生成物Cl2的相对分子质量大于71 D. 该反应转移的电子数为6e-
7.根据热化学方程式: S(s)+O2(g)=SO2(g);△H=-297.23kJ/mol
分析下列说法中正确的是
A. S(g)+O2(g)=SO2(g);△H>297.23kJ/mol
B. S(g)+O2(g)=SO2(g);△H<297.23kJ/mol
C. 1molSO2(g)所具有的能量大于1molS(s)与1molO2(g)所具有的能量之和
D. 1molSO2(g)所具有的能量小于于1molS(s)与1molO2(g)所具有的能量之和
8. 设NA表示阿伏加德罗常数,下列说法中正确的是
A. 1mol甲基正离子(CH3+)所含电子数为8NA
B. NA个 H2分子的质量约为2g,它所占的体积约为22.4L
C. 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为NA
D. 500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA
9. 2002年10月26日,俄罗斯特种部队在解救歌剧院人质时,使用的气体中可能有芬太奴,芬太奴的结构简式为 ![]() ,它是一种医疗上速
,它是一种医疗上速
效强力镇痛药。下列关于芬太奴的说法不正确的是
A. 分子式为C19H23N2O
B. 芬太奴属于芳香族化合物
C. 芬太奴显碱性
D. 芬太奴既能与盐酸反应,又能与热的氢氧化钠溶液反应
10. 某原电池的总反应方程式为2Fe3+ +Cu == 2Fe2+ + Cu2+,能实现该反应的原电
池为
| A | B | C | D | |
| 正极材料 | Cu | 石墨 | Fe | Ag |
| 负极材料 | Fe | Cu | Cu | Cu |
| 电解质溶液 | CuSO4 | Fe2(SO4)3 | FeCl3 | AgNO3 |
11. 某无色透明溶液能与铝作用放出氢气,此溶液中能大量共存的离子组是
A. OH—、NO3—、Ba2+、Cl— B. H+、Ba2+ 、Mg2+、NO3—
C. Cu2+、H+、Al3+、SO42— D. Na+、K+、MnO4—、Cl—
12. 下列各溶液中,微粒的物质的量浓度关系正确的是
A. 0.1mol /L的(NH4)2SO4溶液中
c(SO42-)>c(NH4+ )>c(H+)>c(OH-)
B. 0.2m01 /L的Na2CO3溶液中
c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C. 0.1mol /L的NH4Cl溶液与0.05mol L-l的NaOH溶液等体积混合
c(Cl-) >c(Na+ ) >c(NH4+ ) >c(OH-) >c(H+)
D. c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4C1溶液
c[(NH4)2SO4] <c[(NH4)2CO3] <c(NH4C1)
13.下列反应的离子方程式书写正确的是
A.向饱和碳酸氢钙溶液中加入过量的氢氧化钠溶液
Ca2++HCO3-+OH-=CaCO3↓+H2O
B.向氯化铝溶液中加入过量氨水
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.碳酸钡溶于醋酸溶液
BaCO3+2H+=Ba2++CO2↑+H2O
D.在三氯化铁的酸性溶液中通入足量的硫化氢
Fe3++H2S=Fe2++S↓+2H+
14. 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质: ①FeCl3 ②Fe2O3
③Cu(NO3)2 ④KNO3,铜粉溶解的是
A.只有①或② B. 只有②或④
C. 只有①或②或③ D. 上述四种物质中任意一种
15.有一固体混合物,其中硫元素和氧元素的质量分数分别为x和(1-3x),则该混合物的组成可能是
A. CuSO4、FeSO4、CuSO3 B. CuSO4、CuSO3、CuS2O3
C. ZnSO4、FeSO4、CuSO4 D. CuS、Cu2S、CuSO4
三、选择题(本题包括5个小题,共15分。每小题有1个选项符合题意)
16. 纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质
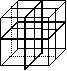 的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的
的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的
大小和形状相同(如右图所示),则这种纳米颗粒的表面粒子数
与总粒子数的比值为
A. 7:8 B. 13:14 C. 25:26 D. 26:27
17.中和一定量的某醋酸溶液时,消耗氢氧化钠mg。如果先向该醋酸的溶液中加入少量醋酸钠,然后再用氢氧化钠中和此醋酸溶液,此时可消耗氢氧化钠ng。则m和n的大小关系是
A.m > n B.m < n C.m=n D.无法确定
18. 下列各种物质中,不能通过化合反应生成的是
A.FeCl2 B. Ba(OH)2 C. Fe(OH)3 D. Cu(OH)2
19.在实验室遇到下列事故时采取的临时紧急措施中,正确的是
A.不小心将浓硫酸弄到手上时,立即用大量水冲洗
B.不小心将苯酚弄到手时,用稀的NaOH溶液洗涤
C.实验时不小心碰翻酒清灯引起实验桌上洒落的少量酒精起火时迅速用泡沫式灭火器灭火
D.实验时不慎被玻璃划破手指引起轻微流血时用FeCl3溶液涂抹止血
20.向200mL0.1mol/LFeCl2溶液中加入适量NaOH,使Fe2+恰好完全沉淀,小心加热此混合物,直至水分蒸干,然后灼烧到质量不再变化,此时固体的质量为
A. 1.6g B. 2.14g C. 3.94g D. 4.36g
|
 高三第一次联考
高三第一次联考
化学试卷答题卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 总分 |
| 分数 |
第I卷答案(一、二、三大题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(非选择题,共55分)
四、(本大题包括2个小题,共16分)
21.( 6分)回答下列问题(填序号):
(1)下列仪器中:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗
⑥滴定管 ⑦燃烧匙,常用于物质分离的是 ,其中根据物质
沸点不同分离物质的仪器是 。
(2)实验室有贮存以下物质的方法:A. 少量白磷贮存在水中;B.金属钠常保存
在煤油或石蜡油中;C. 少量晶体碘贮存在酒精中;D. 浓硝酸贮存在无色的细
口玻璃瓶中。其中正确的是 。
22.(10分)某样品为Na2CO3和NaHCO3的固体混合物。拟将一定质量的样品与稀硫酸反应,用测出生成CO2(密度按1.977g/L计)体积的方法计算出样品中组分的质量分数。为较准确的测出生成的CO2的体积,在反应结束后加热反应混合液,使溶于溶液的CO2逸出,待冷却后再测CO2的体积。(加热时蒸发的水的体积不计)。下图是实验装置,其中包括B和C可供选择。
(1) 用托盘天平称取样品mg,若所用天平游码的最大刻度为5g,则与此天平配套的砝码中最小的质量是 (选填编码: A. 1g B. 2g C. 3g D. 5g E. 10g)。
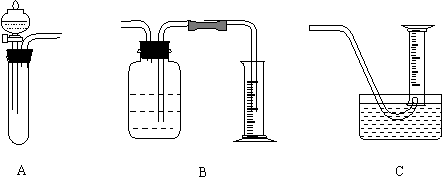 |
(2) 对A进行气密性检查的最简单方法是
。
(3) 已知所用硫酸的浓度为0.5mol/L,A中试管的规格是20mm(内径)×200mm(高度),则在称此样品时,m的值应不大于 g。测定气体的体积所用量筒的规格,合适的是 。(请填下面选项中的字母)
A.100mL B.200mL C.500 mL D.1000mL
(4) 测量CO2气体的体积时,可选用B、C中的一种与A连接,你将选择 。(填B或C),不选另一种的理由是
。
![]() 五、(本题包括2个小题,共12分)
五、(本题包括2个小题,共12分)
23.(6分)可逆反应 A(g)+2B(g) 2C(g);△H (△H >0)
在一定条件下达到平衡。若改变条件,试将变化情况(增大,减小,不变)填入空格:
(1) 升高温度,B的转化率____ 。
(2) 加催化剂,A的物质的量____ 。
(3) 保持温度和压强不变加入稀有气体,则C的物质的量____ 。
(4) 保持温度和体积不变加入稀有气体,则A的转化率____ 。
(5) 若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的密度 ,混合气体的平均相对分子质量 。
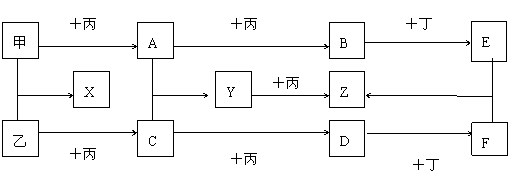 24.(6分) 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的摩尔质量比Z小16,乙与丙的摩尔质量相同,B的摩尔质量比D的小2,B与X的摩尔质量相同,各物质转化关系如下图(各反应条件已略去)。
24.(6分) 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的摩尔质量比Z小16,乙与丙的摩尔质量相同,B的摩尔质量比D的小2,B与X的摩尔质量相同,各物质转化关系如下图(各反应条件已略去)。
(1) 丙、B的分子式分别为 、 。
(2) Y转化为Z的化学方程式 。
(3) E与F反应的离子方程式 。
六、(本题包括2个小题,共20分 )
25. (8分) 通常,烷烃可以由相应的烯烃经催化加氢得到。但是,有一种烷烃A,分子式C9H20 ,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A 、B1、B2、B3的结构简式如下(请填空)

![]()

![]() A:
B1~B3:
A:
B1~B3:
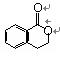
26. (12分)A为某芳香烃的衍生物,只含C、H、O三种元素,环上有两个取代基。又已知A的相对分子质量为150,A不能使FeCl3溶液显色,但可被新制Cu(OH)2氧化为B,B能浓硫酸存在和加热时,发生分子内的酯化反应生成C,C分子中有一个含氧的六元环。
(1)B分子中的含氧官能团 、 (填名称);
(2)写出符合上述条件的A的可能的结构式:
;
(3)写出任一一种A与新制Cu(OH)2反应的化学方程式:
;
(4)写出任意一种B生成的C的结构简式:
C: 。
七、(本题共7分)
27. 硫铁矿在高温下被氧气氧化并产生SO2气体:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2占4/5、O2占1/5,试完成下列各题:
(1) 55L空气和足量FeS2完全反应后,气体体积(同温同压下,下同)变为 L。
(2) 充分反应后(空气过量),则所得混合气体中SO2的体积分数n的取值范围
(以分数表示)。
(3) 若所得混合气体中SO2的体积分数为0.08,则所得混合气体中O2的体积分数 。
(4) 若该反应过程中,转移22mol电子,试通过计算确定用生成的SO2最多可制得98%的硫酸多少克?
高三联考化学试题
参考答案参考答案暨评分标准
一、(2×5=10分)
1.B 2. B 3. B 4. D 5. C
二、(3×10=30分)
6. A 7. A D 8. A C 9. A 10. B 11. A 12. B D 13. B 14. D 15. C
三、(3×5=15分)
16.D 17. C 18. D 19. D 20. C
四、(16分)
21.(每空2分,共6分) (1)①③⑤ ③ (2)A B
22.(10分)(1)D (2分)
(2)夹紧弹簧夹,在分液漏斗中加水,打开活塞,若水流下一部分后不再流下,则气密性好(2分)
(3)1.1g (2分)
(4)C (2分)
(5)应选B 因C易引起倒吸,准确度没有B好(每空1分,共2分)
五、(12分)
23.(每空1分,共6分)(1)增大 (2)不变 (3)减小 (4)不变
(5)不变 增大
24.(6分)(1)O2 Na2O2(每空1分,共2分)
(2) 2Na2SO4+O2=2Na2SO4(2分)
(3) H++OH-=H2O(2分)
六、(20分)
25. (每空2分,共8分)
A (CH3)3CCH2C(CH3)3 B1 (CH3)3C-C(CH3)2-CH2CH3
B2 (CH3CH2)4C B3 (CH3)2CHC(CH2)2CH(CH3)2
26. (12分,每空2分)(1) 羧基 羟基
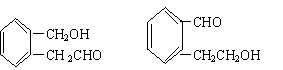 |
(2)
(3)
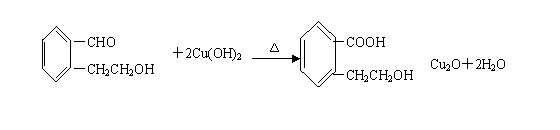

(4) 
七、(7分)(1小题1分,其余各2分)
(1)52L (2)0< n < 2/13 (3)0.096 (4)400