高三化学第二学期月考
1.下列反应中,通入的气体物质只作为还原剂的是
( A )氯气通入氢氧化钠溶液 ( B )二氧化硫通入氢硫酸 1 D
( C )硫化氢通入硫化钠溶液 ( D )硫化氢通入溴水
2.在由水提供的C(H+)=1×10-14mol/L的水溶液中一定能大量共存的离子组是( )
( A )Fe2+、Fe3+、SO42-、Cl-、NO3- ( B )Na+、Br-、SO32-、S2O32-、ClO- 2 D
( C )Al3+、K+、Cl-、NO3-、Br- ( D )Cs+、I-、SO42-、Li+、Cl-
3.下列递变规律叙述正确的是 ( ) 3. A
A.O、S、Na、K的原子半径依次增大 B.Na、Mg、Al、Si的还原性依次增强
C.HF、HCl、H2S、PH3的稳定性依次增强 D.CH4、NaCl、SO2、SiO2的熔点依次增高
4.下列各组溶液间的反应可用同一离子反应方程式表示的是 ( ) 4 C
( A )碳酸钠和盐酸,碳酸钙固体溶于盐酸 ( B )硫酸铵和氢氧化钡,硫酸铵和氢氧化钠
( C )硫酸氢钠和碳酸钠,盐酸和碳酸钠 ( D )溴化钠和足量氯气,溴化亚铁和足量氯气
5. 下列物质置于空气中,pH下降的是 ( ) 5. D
A.硫酸亚铁溶液 B.氢硫酸溶液 C.碘化钾溶液 D.亚硫酸钠溶液
6. 下列分子的空间构型为正四面体的有 ( ) 6. C
①CCl4 ②P4 ③金刚石 ④单晶硅 ⑤CH4 ⑥NH4+
A.全部 B.①②⑤⑥ C.①②⑤ D.③④
7. X、Y、Z三元素的离子具有相同的电子层结构.原子半径X>Y,离子半径Y<Z.Y和Z能形成离子化合物.由此可知:三元素原子序数的关系是 ( ) 7. D
A.X>Y>Z B.Z>X>Y C.Y>Z>X D.Y>X>Z
8.下列物质在空气中易变质,但不是发生氧化还原反应的是 ( )
( A )氢硫酸 ( B )Na2SiO3溶液 ( C )Na2O2 ( D )Na2SO3 8. B
9.下列操作中,没有明显沉淀现象的是 ( )
( A )硝酸钡溶液中通入SO2 ( B )硝酸银溶液滴入磷酸溶液中 9. B
( C )氢氧化铁胶体中滴入少量浓盐酸 ( D )苯酚钠溶液中通入过量CO2
10. 某金属硝酸盐的水溶液,用铂电极电解时,0℃,1.01×105Pa下,在阳极产生气体560mL,在阴极上析出金属mg,若金属的化合价为+n,则金属的相对原子质量为 ( ) 10. D
A.m·n B.m/n C.20mn D.10mn
11. 用惰性电极电解下列溶液,过一段时间后,溶液pH变小的是 ( )
①H2SO4②NaOH③KBr④Cu(NO3)2⑤HCl11. C
A.①② B.③④ C.①④ D.④⑤
12. 在原容积相同的甲、乙两个密闭容器中,均分别充入2mol二氧化硫和1mol氧气,发生反应
2SO2 + O2 ![]() 2SO3,在相同温度下达到平衡状态,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中二氧化硫的转化率为25%,则乙容器中二氧化硫的转化率可能
2SO3,在相同温度下达到平衡状态,若甲容器始终保持体积不变,乙容器始终保持压强不变,达平衡时测得甲容器中二氧化硫的转化率为25%,则乙容器中二氧化硫的转化率可能
A.25% B.<25% C.>25% D无法确定
13. 在一定条件下,测出2CO2![]() 2CO+O2达到平衡,体系的平均相对分子质量为M,在此条件下,用来表示CO2分解率的公式是 ( )13. B
2CO+O2达到平衡,体系的平均相对分子质量为M,在此条件下,用来表示CO2分解率的公式是 ( )13. B

14. 将pH=3的酸和pH=11的碱溶液等体积混合,混合后溶液的pH ( ) 14. D
A.>7 B.=7 C.<7 D.无法确定
15. 氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生,下列叙述不正确的是
![]() B.NH4H固体投入少量水中,有两种气体产生
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大 D.NH4H溶于水后,形成的溶液显酸性
16.将CO、O2混合气200mL置于密闭容器中点爆,再恢复至原状况,气体变为150ml,则原混合气中CO的体积可能为 ( )16. BC
(A)50ml (B)100mL (C)150ml (D)180ml
17.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
(A)17g氨中共价键的数目为NA 17. BC
(B)aL标准状况下的HCl气体的分子数为a NA /22.4
(C)0.1mol/L的Na2SO4溶液中,单位体积内Na+的个数为0.2 NA /L
(D)用惰性电极电解NaCl溶液,每生成NaOH a g,电路中通过的电子数为a/ NA
18.砷为第四周期VA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )18. D
A.砷在通常状况下是固体 B.可以有-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱 D.砷的还原性比磷弱
19、20mL 1mol/L醋酸溶液跟40mL 0.5mol/L氢氧化钠溶液混合,所得溶液中离子的浓度由大到小的顺序是 ( )19. AB
(A) C(Na+)>C(CH3COO- )>C(OH-)>C(H+)
(B) C(Na+)=C(CH3COO- )+ C(CH3COOH )
(C) C(Na+)>C(OH-)>C(CH3COO- )>C(H+)
(D) C(Na+)>C(OH-)>C(H+)>C(CH3COO- )
20. 在下列两图中,V表示反应速率,C%表示某反应物在平衡体系中的体积分数,P表示压强,t表示反应时间,图(I)为温度一定时,压强与反应速率的关系曲线;图(Ⅱ)为压强一定时,在不同时间的C%与温度的关系曲线。在下列反应中,同时符合以上两个图象的是( ) 20. A
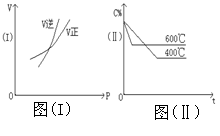 A.4NH3(气)+5O2(气)
A.4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)△H =-808.7kJ
4NO(气)+6H2O(气)△H =-808.7kJ
B.N2O3(气) ![]() NO2(气)+NO(气) △H = 41.8kJ
NO2(气)+NO(气) △H = 41.8kJ
C.3NO2(气)+H2O(液) ![]() 2HNO3(液)+NO(气)△H =-261.3kJ
2HNO3(液)+NO(气)△H =-261.3kJ
D.CO2(气)+C(固)![]() 2CO(气) △H = 171.4kJ
2CO(气) △H = 171.4kJ
21.(10分)AB2离子化合物的阴、阳离子的电子层结构相同,化合物AB2中共有54个电子,根据下列反应 (1)
AB2 + H2O ![]() X +
H2↑ + B2↑
(2) X + B2 →
Y + AB2 + H2O (3) Y + H2O →
X + Z
X +
H2↑ + B2↑
(2) X + B2 →
Y + AB2 + H2O (3) Y + H2O →
X + Z
推断AB2、X、Y、Z的分子式依次为:AB2__________、X__________、Y__________、Z__________。
写出(1)、(2)、(3)三步反应的化学方程式。
(1)____________________,(2)_________________,
(3)____________________。21. CaCl2 Ca(OH)2 Ca(ClO)2 HClO
22.(10分)环境 监测测定水样中溶解氧的方法是:(A)量取a mL水样,迅速加入固定剂、过量MnSO4溶液和含KOH的KI溶液,密闭摇匀,使之迅速充分地发生反应:
2Mn2+ + O2 +4OH- = 2MnO(OH)2;(B)开瓶塞后即加入适量硫酸使溶液酸化,反应生成I2: MnO(OH)2 +2I- + 4H+ = Mn2++I2+3H2O;(C)用b mol/LNa2S2O3标准液滴定水样中的I2,消耗V mLNa2S2O3:I2+2S2O32-=2I-+S4O62-。
(1)上述滴定时,待测液中应以_________________为指示剂,以颜色由_______________变______________为滴定终点。
(2)水样中溶解氧的含量为________________g/L。
(3)a.b两步反应中,____________相当于催化剂。 22 (1)淀粉,蓝,白(或无) (2)8bV/a (3)MnSO4
四、实验推断题(14分)
23.(6分)如图是一套检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清的石灰水变浑浊;若打开活塞K,则品红试液褪色。据此判断气体X和洗气瓶内液体可能是( )(用序号填空)
| 序 号 | A | B | C | D |
| X | H2S | SO2 | CO2 | Cl2 |
| Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
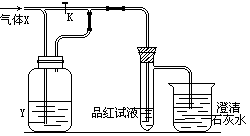
23. B 24.(8分)某学生欲用H2O2催化分解来制取氧气,用浓氨水和生石灰反应来制取氨气。现有下列仪器装置(另有短乳胶管)可供选择:
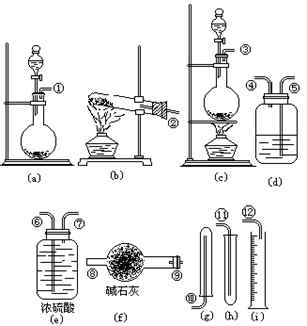
(1)若制取干燥氧气,应选用的仪器是_________________________,按气流方向连接的顺序是________________________________;
(2)若测定生成O2体积以确定H2O2含量应选用的仪器是____________________,按气流方向连接的顺序是________________________________。
24.(1)、(a)、(e)、(h) ①→⑦→⑥→⑾ (2)、(a)、(d)、(i);①→④→⑤→⑿ 五、简答题(共13分)
25、(6分)将AlCl3溶液加热,蒸干,灼烧,最后所得到的重要固体产物是什么?用化学方程式加以表示,并配以必要的文字说明。25. Al2O3。AlCl3+3H2O![]() Al(OH)3+3HCl为吸热反应,加热使水解平衡向正方向移动,又有HCl挥发,使AlCl3 完全水解得Al(OH)3,加热Al(OH)3使之分解 2Al(OH)3
Al(OH)3+3HCl为吸热反应,加热使水解平衡向正方向移动,又有HCl挥发,使AlCl3 完全水解得Al(OH)3,加热Al(OH)3使之分解 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
26.(7分)化合物SOCl2常温下为液态,沸点77℃,在盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到反应剧烈,液面上有白雾生成,并有刺激性气味气体逸出,该气体可使湿润品红试纸褪色,轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀生成。
(1)根据上述现象,写出SOCl2与水反应的方程式。
(2)工业上常利用ZnCl2·3H2O和SOCl2混合后共热来制取无水氯化锌,请简述该法的制备原理。
26. (1)SOCl2+H2O=2HCl+SO2↑ (2)一方面SOCl2因水解而消耗了ZnCl2·3H2O的结晶水;另一方面SOCl2的水解产生的HCl抑制了ZnCl2的水解。
六、计算题(共18分)
27.(8分)将氮气、氢气按一定比例混合,装入一定容的密闭容器中,在一定条件下进行反应。达平衡时,在反应混合物中,氨气的体积分数为20%。求反应前后(温度相同)容器内气体的压强比。
27.6︰5。
28.(10分)往400mL 0.3mol/L NaOH溶液中通入一定量的CO2气体,然后在低温下蒸发溶液,得白色固体A为7.6g。试推算:
(1)A的可能成分。(2)组成A的物质的质量。(3)求通入的CO2气体在标准状态下的体积。
第二学期高三化学
1.D 2.D 3.A 4.C 5.D 6. C 7. D 8. B 9. B 10. D 11. C 12. C 13. B 14. D 15.D 16. BC 17. BC 18. D 19. AB 20. A
21.(10分) CaCl2 Ca(OH)2 Ca(ClO)2 HClO
22.(10分) (1)淀粉,蓝,白(或无) (2)8bV/a (3)MnSO4
23.(6分) B
24.(8分)(1)、(a)、(e)、(h) ①→⑦→⑥→⑾ (2)、(a)、(d)、(i);①→④→⑤→⑿
25.(6分) Al2O3。AlCl3+3H2O![]() Al(OH)3+3HCl为吸热反应,加热使水解平衡向正方向移动,又有HCl挥发,使AlCl3
完全水解得Al(OH)3,加热Al(OH)3使之分解 2Al(OH)3
Al(OH)3+3HCl为吸热反应,加热使水解平衡向正方向移动,又有HCl挥发,使AlCl3
完全水解得Al(OH)3,加热Al(OH)3使之分解 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
26.(7分) (1)SOCl2+H2O=2HCl+SO2↑ (2)一方面SOCl2因水解而消耗了ZnCl2·3H2O的结晶水;另一方面SOCl2的水解产生的HCl抑制了ZnCl2的水解。
27.(8分)27.6︰5。
28.(10分)28.(1)A为碳酸钠和碳酸氢钠的混合物;(2)碳酸钠4.24 g、碳酸氢钠3.36 g;(3)1.792L。