高三化学第一轮基础验收考试
本试卷考试时间90分钟,满分100分
相对原子质量:H:1 C:12 O:16 Mg:24 Al:27 Cl:35.5
一、选择题(单选,本题包含10小题,每题2分,共20分)
1.下列现象的产生与人为排放大气污染物氮氧化物无关的是 ( )
A.闪电 B.光化学烟雾 C.酸雨 D.臭氧层空洞
2.使用化学方法可以消除某些环境污染,下列措施属于化学方法的是 ( )
A.废旧塑料重熔、重新成型 B.用多孔吸附剂清理水面油污
C.在燃煤中加入氧化钙 D.将垃圾深埋
3.下列物品的用途与新型无机非金属材料无关的是 ( )
A.切割玻璃的刀 B.用于通讯的光缆
C.钟表的轴承 D.普通玻璃
4.下列物质放置于空气中易风化的是 ( )
A.粗食盐 B.碘单质 C.MgCl2·6H2O D.Na2CO3·10H2O
5.人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐,则使血红蛋白中Fe2+转化为Fe3+丧失
其生理功能,临床证明服用维生素C可以解毒。下列叙述正确的是 ( )
A.中毒反应中亚硝酸盐是还原剂
B.中毒反应中Fe3+是氧化剂
C.维生素C能将亚硝酸盐氧化成硝酸盐,使其解毒
D.维生素C能将Fe3+还原成Fe2+,使其解毒
6.只用一种试剂就可以将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,这种试
剂是 ( )
A.BaCl2溶液 B.FeCl2溶液
C.FeCl3溶液 D.Fe(NO3)3溶液
7.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构
相同(a、b、c、d为元素的原子序数),则下列关系正确的是 ( )
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
8.在一密闭容器中,反应aA(g)=bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,
当达到新的平衡时,B的浓度是原来65%,则 ( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
9.下列各组中,两种气体的分子数相等的是 ( )
①温度相同、体积相同的O2和N2 ②质量相等、密度不等的N2和C2H4
③体积相等、密度相等的CO和C2H4 ④压强相同、体积相同的N2和O2
A.①② B.②③ C.③④ D.①④
10.工业上常用水吸收HCl气体制盐酸。经测定某盐酸的物质的量浓度为12.0mol/L,密度
为1.19g/cm3,则用于吸收形成100mL此盐酸的水的体积是 ( )
A.75.2mL B.85.5mL C.90.8mL D.100mL
二、选择题(单选,本题包含11小题,每题3分,共33分)
11.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量CO2 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量SO2 NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
12.将等物质的量的镁和铝相混合,取四份等质量的混合物分别加到足量的下列溶液中,充
分反应后,放出氢气最多的是 ( )
A.3mol/L HCl B.4mol/L HNO3
C.8mol/L NaOH D.18mol/L H2SO4
13.为了鉴别硫酸溶液和水,设计了5种方案:
①用量筒量取相同体积的两种液体,分别置于两只相同的烧杯中,置于托盘天平两托盘
上,质量较大者为硫酸溶液
②取样,分别加入无色酚酞试液,能使酚酞变色的是硫酸溶液
③以电导装置分别测试它们的导电性,导电能力强的是硫酸溶液
④在两种液体的试样中,分别加入少量铁粉,铁粉溶解且生成浅绿色溶液的是硫酸溶液
⑤取两块完全相同的小木块,分别置于两种液体中,露出体积大者是硫酸溶液
你认为上述方案中不合理的是 ( )
A.只有② B.只有①② C.只有②③④ D.全部
14.某学生只有锥形瓶、集气瓶、玻璃导管、带孔胶塞、胶皮管、分液漏斗、水槽等仪器以
及所需的药品,按常规实验室制法他可以制取和收集的气体是 ( )
A.Cl2、NH3 B.CO2、C2H4 C.H2、C2H2 D.O2、NO
15.有Na2CO3、AgNO3、BaCl2、HCl、NH4NO3 5瓶无标签的溶液,为鉴别它们,取4支试
管分别装入一种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列表达中错误
的是 ( )
A.若3支试管出现沉淀时,则后加入的是AgNO3溶液
B.若全部没有什么现象变化时,后加的是NH4NO3溶液
C.若1支试管出现气体,2支试管出现沉淀时,最后加入的是HCl溶液
D.若只有2支试管出现沉淀其他试管均无明显现象时,则后加的是BaCl2溶液
16.下列有关物质性质的比较正确的是 ( )
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③ B.②④ C.③⑥ D.⑤⑥
17.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型
Si60分子中,外面的硅原子与里面的碳原子以共价健结合。下列关于这种物质的叙述中
正确的是 ( )
A.是混合物 B.是化合物 C.不含极性键 D.含有离子键
18.将0.01mol/L NaOH与0.02mol/L CH3COOH溶液等体积混合后,溶液中下列关于正确的
是 ( )
A.c(CH3COO-)<c(Na+)
B.c(CH3COOH)>C(CH3COO-)
C.2c(H+)=c(CH3COO-)-c(CH3COOH)
D.c(CH3COOH)+c(CH3COO-)=0.01mol/L
19.常温时A物质的溶解度为15g,B物质的饱和溶液的质量分数为15%,而浓度为15%的
C物质溶液100g,蒸发掉15g水,恢复到常温时析出晶体1g,则此三种物质在常温时的
溶解度SA、SB、SC由大到小的顺序正确的是 ( )
A.SA>SB>SC B.SC>SB>SA C.SC>SA>SB D.SC=SB>SA
|
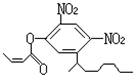
20.阿乐丹的结构简式可简写为 ,它在稀酸作用下能水解生成两种
有机物,这两种有机物可能共同具有的性质是 ( )
①均能与NaOH溶液反应; ②遇FeCl3溶液均显紫色;
③一定条件下均能与氢气发生加成反应; ④均能与溴水发生加成反应
A.①③ B.②④ C.①④ D.②③
21.某一元醇A和一元羧酸B形成的酯的相对分子质量为212,分子内碳原子数是氢、氧原
子数之和。该酯不能使溴的四氯化碳溶液褪色,又知A可氧化碳溶液褪色,又知A可氧
化得B,则下列叙述正确的是 ( )
A.该酯符合通式CnH2nO2
B.B的相对分子质量比A大16
C.该酯中一定不存在双键
D.酯、A、B三种分子中都含有一种相同的相对分子质量大于45的原子团
|
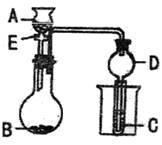
22.(17分)用如图装置进行实验,将A逐滴加入B中:
(1)若A为流酸,B为第三周期金属元素的片状单质,
其在常温下难与水反应,C为品红溶液,实验中观
察到溶液褪色,则B是 (写化学式),
根据题意写出B与浓H2SO4的化学方程式 ;反应后往烧杯中加入沸水,
又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为C6H5Ona溶液,实验中观察到小试管内溶液变浑浊,则酸A
应具有的性质是 ,25℃时等物质的量浓度的B、C两溶液
pH大的是 (填化学式);然后往烧杯中加入沸水,可观察
到试管C中的现象是 。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清
时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,
则A是 (写名称),C是 (写化学式)与乙醛
的混合液,该反应的离子方程式 ,仪器D
在此实验中的作用是 。
23.(9分)化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
|
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是 。
①以上反应是可逆反应 ②充电时化学能转变为电能
③放电时化学能转变为电能 ④在放电时Cd发生还原反应
(2)若该电池提供5库仑电量(不计损耗),则消耗的负极材料质量约为
(相对原子质量Cd:112 NiO(OH):91.7 Ni(OH)2:92.7 Cd(OH)2:146 电
子电量:1.60×10-19C)
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平
方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为:
。
(4)下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
![]()
生物体D中重金属浓度 生物体A(填“大于”或“等于”或“小于”)中
重金属浓度,这是通过食物链 作用所引起的,除上述途径外,被污
染水体中的重金属还可以直接通过 (途径)进入人体。
24.(4分)被称为“绿色氧化剂”的过氧化氢(H2O2)俗名双氧水,是一种无色的液体,常
用作氧化剂、消毒杀菌剂和漂白剂等。
(1)向含有酚酞的NaOH溶液中滴加双氧水,溶液由红色褪至无色主要原因是双氧水的
性。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色褪去,此时双氧水表现出
性。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水擦洗后又恢复原貌,
有关反应的化学方程式为
25.(9分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化
合物A(C4H8O3)制得,如图所示,B和D互为同分异构体。
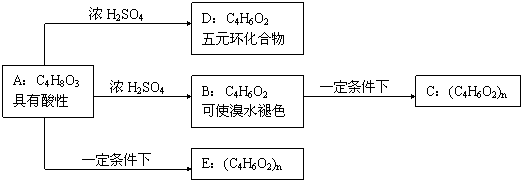 |
试写出:
(1)化学方程式:A→D: ;B→C: ;
(2)反应类型:A→B ;A→E: ;
(3)E的结构简式为 ;写出A的同分异构体(同类别且有碳支
链)的结构简式 和
三、计算题 共8分
26.(8分)甲醇是一种重要的醇,它可以做内燃机的燃料和溶剂,也是一种重要的化工原料,
同时它在废水处理中也有重要应用。
(1)在25℃时1g甲醇完全燃烧后恢复至原温度时可放出24.2kJ热量,则25℃时1mol
甲醇完全燃烧生成100℃时CO2和水蒸气应放出 kJ热量。(保留整数)
(有关热量公式Q=m·C·△t Q=m·J, 已知水的比热C=4.18J·g-1·℃-1,水
的液化热J=2253J·g-1m:物质质量 △t:温度差 假设100℃时水完全汽化,并忽
略CO2吸热)
(2)甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+NH3=NO3-+H++H2O, 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,NH3→NO3-的转化率为95%,NO3-→N2的转化率为
86%。若每天处理此种含NH3为34mg/L的废水500m3(密度1g/cm3)需要甲醇多
千克?(要求写出解题步骤,保留至小数点后一位)
第一轮基础验收考试
化学参考答案
选择题
1.A 2.C 3.D 4.D 5.D 6.C 7.D 8.C 9.B 10.A 11.D 12.A 13.A 14.C
15.C 16.C 17.B 18.D 19.B 20.A 21.D
22.(17分)(1)Mg;Mg+2H2SO4 (浓)=MgSO4+SO2↑+2H2O;C中溶液变红 (2)酸性
![]() 比碳酸的酸性强;Na2CO3;溶液由浑浊变成澄清 (3)浓氨水(可铵盐的浓溶液);AgNO3
比碳酸的酸性强;Na2CO3;溶液由浑浊变成澄清 (3)浓氨水(可铵盐的浓溶液);AgNO3
CH3CHO+2[Ag(NH3)2]++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O防止倒吸
23.(9分)(1)③ (2)2.91×10-3g (3)Ni(OH)2和Cd(OH)2能溶于酸性溶液。
(4)大于;富集;饮水
24.(4分)(1)氧化(或漂白) (2)还原 (3)PbS+4H2O2=PbSO4+4H2O
![]()
![]() 25.(9分)
25.(9分)
(1)HOCH2CH2CH2COOH CH2—C +H2O;nch2=CH—CH2COOH
![]()
![]() [ CH2—CH ]n
[ CH2—CH ]n
![]()
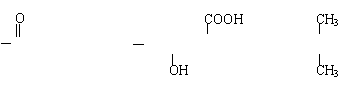 (2)消去反应;缩聚反应;
(2)消去反应;缩聚反应;
(3) [ C—CH2CH2CH2—O ]n ;CH2—CH—CH3 ;HO—C—COOH
26.(8分)(1)682;
(2)解:由反应2O2+NH3=NO3-+H++H2O,
6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
得关系式:6NH3—6NH3-—5CH3OH—3N2↑
![]()
![]() 根据关系式6NH3
5CH3OH
根据关系式6NH3
5CH3OH
6mol 5×32×10-3kg
1000mol×95%×86% m(CH3OH)
![]()
答:消耗甲醇21.8kg