高三化学第一学期期末考试
试题
考试时间:120分钟 满分150分
第Ⅰ卷(选择题,共72分)
一、选择题:(本题包括8小题,每小题4分,共32分;每小题只有一个选项符合题意)
1、“纯净水”、“太空水”、“蒸馏水”等作为日常饮用水,因缺少某种成分而不利于儿童的健康发育,你认为制备上述饮用水时至少还需要添加的化学物质是 ( )
A. 钙、镁的碳酸盐 B. 含碘酸钾的食盐 C. 漂白粉消毒剂 D. 小苏打
2、周期表中,有人认为位于第IA族的氢元素,也可以放在ⅦA族,下列物质支持这种观点的是 ( )
A. HF B. H3O+ C. NaH D. H2O2
3、为了从新制的氯水中制得高浓度的次氯酸,可向氯水中加入的试剂是 ( )
A. Na2CO3 B. H2SO4 C. CaCO3 D. Ca (OH)2
4、“家庭小实验”是指利用家庭生活用品进行化学实验,从而对化学进行学习和探讨的活动,下列实验中,不能在家庭中完成的是 ( )
A. CO2气体不能支持蜡烛燃烧 B. 检验自来水中是否含有Cl-
C. 除去热水瓶中的水垢 D. 鉴别羊毛织物和化纤织物
5、下列物质的溶液中分别加入一定量的Na2O2固体,不会出现浑浊现象的是 ( )
A. 饱和氯化钙溶液 B. 碳酸氢钙溶液 C. 亚硫酸钠溶液 D. 饱和氢硫酸溶液
6、下列微粒的空间构型不是正四面体结构的是 ( )
A. NH4+ B. CF4 C. SiC D. PH3
 7、某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上,另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液依次是
( )
7、某学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上,另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液依次是
( )
A. 石蕊、浓HCl B. 酚酞、浓H2SO4
C. 甲基橙、NaOH浓溶液 D. 酚酞、浓氨水
8、下列说法不正确的是 ( )
A. 卤族元素、氧族元素、碱金属元素的单质随原子序数的递增熔沸点逐渐升高
B. pH = 13的强碱溶液与pH = 1的强酸溶液等体积混和后,所得溶液的pH一定等于7
C. 已知F-、Cl-、Br-、I-结合质子(H+)的能力依次减弱,则NH4F、NH4Cl、NH4Br、NH4I的稳定性依次增强
D. 加热时,碳酸氢钠比碳酸钠易分解
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。只要选错一个,该小题就为零分;若正确答案包括两个选项,只选一个且正确的给2分)
9、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一气体,则有沉淀。则通入的气体不可能是 ( )
A. CO2 B. NH3 C. NO2 D. NO
10、下列各组离子能在溶液中大量共存且溶液显碱性的是 ( )
A. Al3+、Mg2+、SO42-、NO3- B. NH4+、OH-、Na+、Cl-
C. AlO2-、Cl-、Na+、K+ D. ClO-、S2-、Na+、K+
11、相同体积的一元酸HA的溶液和一元碱ROH的溶液相混合后pH = 7,下列叙述中正确的是 ( )
A. 0.01 mol/L的BOH溶液的pH 一定等于12 B. 生成的盐BA一定不水解
![]() C. 一定有如下关系c (A-) = c (B+)
D. 一定是相同浓度的强酸强碱相混合
C. 一定有如下关系c (A-) = c (B+)
D. 一定是相同浓度的强酸强碱相混合
12、在一定温度下的定容容器中,当下列物理量不再变化时,表明反应:
A (s) + 2B (g) C (g) + D (g),已达平衡状态的是 ( )
A. 混合气体的体积 B. 混合气体的密度 C. 混合气体的压强 D. B的质量分数
13、氧化铍陶瓷是一种导热性良好的陶瓷,且具有良好的耐酸、耐碱性,对氧化铍而言,下列说法中正确的是 ( )
A. 铍、氧离子电子层结构相同 B. 氧化铍可溶于硝酸
C. 氧化铍的熔点低于氧化钡 D. 氧化铍不可能溶于烧碱溶液
14、设NA表示阿佛加德罗常数,下列叙述中正确的是 ( )
A. 标况下,11.2L四氯化碳所含分子数为0.5NA
B. 1.8g的NH4+中含有的共价键数为0.4 NA
C. 1 mol醋酸分子与NA个醋酸分子的质量相等
D. 2.3g金属24Na变为24Na+ 时失去的电子数为0.1 NA
15、锂电池是新一代高能电池,目前已研究成功多种锂电池,某种锂电池总的反应式为:
Li + MnO2 = LiMnO2,下列说法中正确的是 ( )
A. Li是正极,MnO2是负极 B. 放电时负极的反应:Li - e- = Li+
C. 充电时阳极的反应:MnO2--e-= MnO2
D. 电池放电时,反应混合物的颜色由黑色变成紫色
16、2003年10月15日,我国成功地发射了第一个载人航天飞船——“神舟”五号,从此
向全世界宣告我国进入航天大国和航天强国。此次发射用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2 (g) + 2O2 (g) = 2NO2 (g); △H =
+ 67.7 kJ · mol-1,N2H4 (g) + O2 (g) = N2 (g) + 2H2O (g);△H = -534 kJ · mol-1。下列关于肼和二氧化氮反应的热化学方程式中,正确的是 ( )
A. 2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (l);△H = -1135.7 kJ · mol-1
B. 2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (l);△H = +1135.7 kJ · mol-1
C. N2H4 (g) + NO2 (g) = 3/2N2 (g) + 2H2O (l);△H = -1135.7 kJ · mol-1
D. 2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g);△H = -1135.7kJ · mol-1
17、能正确表示下列反应的离子方程式的是 ( )
A. 用碳酸钠溶液吸收少量SO2: 2CO32- + SO2 + H2O = 2HCO3- + SO32-
B. 碳酸镁溶于硝酸中 CO32- + 2H+ = H2O + CO2↑
C. 氯化铁溶液中通入足量的H2S气体 2Fe3+ + H2S = 2Fe2+ + S↓ + 2H+
D. 氯化铁溶液滴入硫化钠溶液中 2Fe3+ + 3S2- = 2FeS↓+ S↓
18、把7.4g十水碳酸钠和小苏打组成100 ml溶液,c (Na+) = 0.6 mol/L,若把等质量的混合物加热到恒重时,则残留物的质量是 ( )
A. 7.4g B. 3.18g C. 5.2g D. 无法计算
一、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
二、
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共78分)
三、实验题(本题包括2小题,共18分)
19、(8分)(1)通常实验室把金属钠保存在装有一定量煤油的大口试剂瓶中,请具体说明在实验中,你将如何从试剂瓶中取用金属钠。(4分)
(2)试用所学知识解释在常温下Al很难与水反应,但却能与NaOH溶液反应放出H2。(4分)
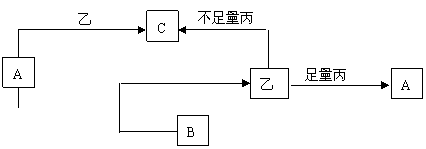 20、(10分)一定条件下发生如图所示的转化关系,其中A、B、C为中学化学中常见元素的化合物,甲、乙、丙均为单质。
20、(10分)一定条件下发生如图所示的转化关系,其中A、B、C为中学化学中常见元素的化合物,甲、乙、丙均为单质。
![]()
(1)若A是CO2,甲能在A中剧烈燃烧 ①化合物B的电子式为 ,
单质丙分子式 ;②现有下列药品和制气装置:实验药品:a.氯酸钾 b.大理石
c.过氧化钠 d.二氧化锰 e.甲酸 f.浓硫酸 g.稀硫酸 h.浓硝酸 i.双氧水 j蒸馏水
可供选择的制气装置:
如要选出其中一种装置,再选择上述所给的一些药品,既可以制取CO2,又可以制取气体丙,该装置最好选择 (填数字代号),制取CO2应选用的药品是 ,制取气体丙的化学反应方程式
③已知实验室常用浓硫酸与甲酸加热反应制取气体C,则可选择的制气装置是
(2)若A、B、C均为溶液,单质乙在常温下为液态,反应均在溶液中进行,写出A与甲按物质的量之比为1:1发生反应的离子方程式
。
四、填空题(本题包括4小题,共43分)
21、(7分)由短周期元素组成的电子数相等的四种离子A-、B+、C2+、D3+。已知A-与B+、C2+、D3+均能反应,其反应现象如下:
|
| B+ | C2+ | D3+ |
| A- | 加热生成气体 | 生成白色沉淀 | 生成白色沉淀,当A过量时沉淀消失 |
(1)写出A-的电子式:
(2)写出离子方程式:
A-+ B+
A- + C2+
A-(过量)+ D3+
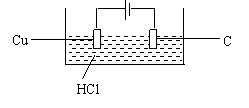
22、(12分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液;CuCl2溶液、HNO3浓溶液、盐酸,按要求回答下列问题:
(1)电工操作中规定不能把Cu导线和铝导线绞拧在一起做为连接使用,请说明原因
(2)若电极材料为Cu和铝,电解质溶液为浓HNO3,能否形成原电池? ;
若能,写出电极反应式,正极
负极 ,若不能请说明理由
| |
使反应Cu + 2H+ = Cu2+ + H2 ↑
能够发生,并指出电极材料和电
解液的试剂。
(4)通常所说的燃料电池都是以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在 极反应, 在另一极反应。
23、(16分)(1)pH = 2的某酸H![]() A与pH=12的某碱B(OH)
A与pH=12的某碱B(OH)![]() 等体积混合后,溶液的pH = 8
等体积混合后,溶液的pH = 8
![]() ①反应所生成正盐的化学式为
;
①反应所生成正盐的化学式为
;
②该盐中 离子一定能水解,水解离子方程式为 ;
(2)试用离子方程式表示下列各变化
①将FeCl3饱和溶液滴入到沸水中 ;
②向①所得的混和物中逐滴加入盐酸: ;
其现象为 ;
③向FeCl3溶液中滴加KSCN ;
若向FeCl3溶液中先加入NaF;再加入KSCN则看不到溶液呈红色,其原因不可能是
(填序号,多选倒扣分)
A、Fe3+强氧化性将F-氧化
B、Fe3+与F-形成复杂的稳定的化合物
C、Fe3+与F-发生双水解转化为Fe (OH)3沉淀
④若向FeCl3溶液中先加入足量的HCl,再加入NaF和KSCN,则仍能显血红色,其原因是 。
24、(8分)材料科学是近年来与化学有关的科学研究的特点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中的常见物质为原料来生产的,图中所示为其生产过程,其中虚线框内转化是为探究C的组成而设,G、F、H均难溶于水且为白色粉末,图中除M,K(均含A元素)外均为中学化学常见物质:
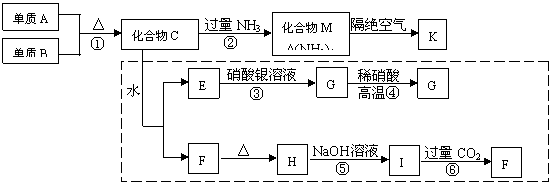
请回答下列问题:
(1)指出K可能所属的晶体类型 ,K晶体中A原子周围化学键的键角均相等,键角值为
(2)写出化学式:单质B ,化合物F
(3)写出下列反应的离子方程式:
反应③ 反应⑤
(4)写出反应④的化学方程式
五、计算题(本题包括2小题,共17分)
25、(11分)把a mol NH3、O2组成的混合气体
导入密闭反应器中,在催化剂存在下发生化学反应。
若混合气体中O2为x mol。反应生成的HNO3为y mol,
试确定O2的物质的量x取不同范围时,HNO3的物质的
量y的计算式,并画出相应的函数图象。
26、(6分)过渡元素钴(Co)具有多种可变化合价,将11.9g CoCO3在空气中加强热,可得8.3g钴的氧化物,试通过计算写出CoCO3在空气中受热后发生反应的化学方程式。
(Co的原子量是:59)(必须写出计算过程)
高三化学期终考试参考答案
一、(4分×8 = 32分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| A | C | C | B | C | D | D | A |
二、(4分×10 = 40分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| AD | C | C | BD | D | BC | BC | D | CD | B |
三、实验题(18分)
19、(8分)(1)答:用镊子从试剂瓶中夹取一块金属钠,用滤纸吸干金属钠表面的煤油,用小刀切下绿豆大小的一块,余下的金属钠放回到原试剂瓶中。(4分)
![]()
![]() (2)答:Al与水反应生成的Al (OH)3是难溶物,覆盖在铝的表面,Al (OH)3是两性氢氧化物,在强碱性溶液中溶解使铝能继续与水反应。(4分)
(2)答:Al与水反应生成的Al (OH)3是难溶物,覆盖在铝的表面,Al (OH)3是两性氢氧化物,在强碱性溶液中溶解使铝能继续与水反应。(4分)
20、(10分)(1)① Mg2+ [ O ]2 - , O2
② Ⅲ,bhj,2Na2O2 + 2H2O = 4NaOH + O2↑
③ Ⅳ
(2)2Cl2 + 2Fe2+ + 2Br- = 4Cl- + 2Fe3+ + Br2
四、填空题(43分)
21、(7分)(1)[ O H]-
(2)OH- + NH4+ = NH3↑+ H2O 或 OH- + NH4+ = NH3 · H2O
2OH- + Mg2+ = Mg (OH)2↓
4OH- + Al3+ = AlO2- + 2H2O
22、(12分)(1)若按上述操作露置于空气中可形成原电池,使铝腐蚀造成短路
(2)能;Al(+) 2H+ + NO3- + e- = H2O + NO2↑
Cu (-) Cu -2e- = Cu2+
(3)
![]()
 (4)负, O2
(4)负, O2
23、(16分)(1)①B![]() A
A![]() ②An-, An- + H2O = HA(n-1) +
OH-
②An-, An- + H2O = HA(n-1) +
OH-
(2)① Fe3+ + 3H2O Fe (OH)3 (胶) + 3H+
② Fe (OH)3 + 3H+ = Fe3+ + 3H2O,先有红褐色沉淀变为棕色溶液
③ Fe3+ + SCN- = Fe (SCN)2+, AC
④ F- + H+ = HF 形成弱电解质HF,使溶液中Fe3+仍能与SCN-反应。
24、(8分)(1),109°28′
(2)Cl2、H2SiO3 (或H4SiO4)
(3)Ag+ + Cl- = AgCl↓,SiO2 + 2OH- = SiO32- + H2O
|
|
|
|
|
|
③当x ≥ ![]() 时,y = a – x
时,y = a – x
26、(6分)解:设有x mol O2生成,则反应式可表示为:
![]()
![]() 2CoCO3 Co2On
+ xO2↑+2CO2↑
2CoCO3 Co2On
+ xO2↑+2CO2↑
119×2 118 + 16n
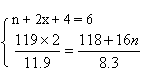 11.9
8.3
11.9
8.3
由氧原子个数相等有:
得n = 3,x = ![]()
x < 0说明O2应作为反应物参加反应
即2CoCO3+
![]() O2 Co2O3
+2CO2
O2 Co2O3
+2CO2