高三化学第一学期期末模拟试题二
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
1.25 mL18.4 mol·L-1的H2SO4中加入足量的木炭并加热使其充分反应,则被还原的硫酸是
A.等于0.23 mol B.大于0.23 mol C.等于0.46 mol D.小于0.46 mol
2.室温时,若PH=2的某一元弱酸的电离度为1%,则下列说法正确的是
A.该弱酸溶液的浓度为0.01 mol·L-1 B.室温时,0.1 mol·L-1的该弱酸溶液pH=2
C.室温时,加入等体积0.1 mol·L-1 NaOH后所得溶液pH<7
D.室温时,pH=3 该弱酸的电离度小于1%
3.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
A.Cl-、Mg2+、NO![]() 、K+
B.NH
、K+
B.NH![]() 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+
D.HCO
、Na+
D.HCO![]() 、K+、NO
、K+、NO![]() 、SO
、SO![]()
4.盐的水解程度大小可以用“水解度”来表示,关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2 L 0.1 mol·
L-1的强碱弱酸盐NaA溶液的pH为10,则A-的水解度是
A.0.01 % B.0.1 % C.0.2 % D.1%
![]() 5.某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(g)+2B(g) 2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时,C气体的体积占50%,则下列推断正确的是
5.某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(g)+2B(g) 2C(g)。若维持温度和压强不变,当达到平衡时,容器的体积为V,此时,C气体的体积占50%,则下列推断正确的是
A.原混合气体的体积为1.25 V B.原混合气体的体积为1.5 V
C.反应达到平衡时气体A消耗了0.5 V D.反应达到平衡时气体B消耗了0.5 V
6.有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为:AG=lgc(H+)/c(OH-),下列表述正确的是
A. 在25℃时,若溶液呈中性,则pH=7,AG=1
B. B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,若溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
7.废水中糖类(CH2O)n经无氧发酵生成的2种化合物是
A.C2H2和H2O2 B.CH4和CO2 C.CH3COOH和HCHO D.CO和H2
8.下列除去括号内杂质的有关操作正确的是
A.苯(苯酚):加浓溴水振荡,分液 B.硝酸(硝酸镁):加热,蒸馏
C.肥皂液(甘油):加食盐颗粒,过滤 D.乙酸乙酯(乙酸):加氢氧化钠溶液,分液
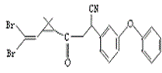 9.拟除虫菊酯是一类高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构式如右图,下列说法正确的是
9.拟除虫菊酯是一类高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构式如右图,下列说法正确的是
A.属于芳香烃 B.属于卤代烃
C.在酸性条件下不水解 D.在一定条件下可以发生加成反应
10.在1000 mL含有等物质的量的HBr和H2SO3溶液中通入0.01 mol Cl2,有一半Br-变为Br2,原溶液中HBr和H2SO3的浓度都等于
A.0.0075 mol·L-1 B.0.008 mol·L-1 C.0.075 mol·L-1 D.0.08 mol·L-1
二、填空题
11.(12分)银器皿日久表面变黑,这是生成硫化银的缘故。若将一定浓度食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,过一定时间后,黑色褪色,有臭鸡蛋气味产生,银被还原出来,试用原电池原理解释并写出相关的电极反应。
正极材料 负极材料 电解质溶液
正极反应 负极反应
总反应:
12.(14分)香豆素是常用于皂用香精及其他日用化工的香料,分子式为C9H6O2,分子中除有一个苯环外,还有一个六元环。我国某科研所曾以下列路线合成香豆素。
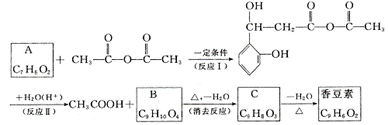 |
(1)试确定有机物A、B、C和香豆素的结构简式:
A_________ B_________ C_________ 香豆素_________
(2)判断反应Ⅰ、Ⅱ的反应类型:(Ⅰ)是_________反应;(Ⅱ)是_________反应。
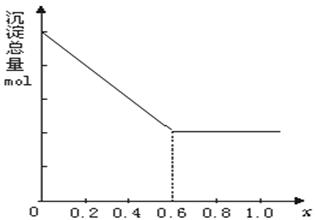
13.(10分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
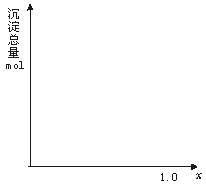
(1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随x(0→1)变化的曲线。
(3)若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
参考答案(二)
一、1.D 2C 3.AD 4.B 5.AD
6.D 7.B 8.BC 9.D 10 .B
11.(12分)
正极:Ag2S、负极:Al 电解质溶液:NaCl
负极反应:2Al-6e-====2Al3+
正极反应:3Ag2S+6e-====6Ag+3S2-
2Al+3Ag2S+6H2O =6Ag↓+2Al(OH)3↓+3H2S↑
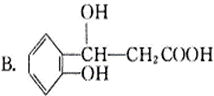 12.(14分)
12.(14分)
(1)
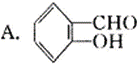
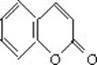
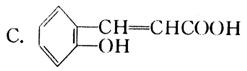 香豆素:
香豆素:
(2)加成 取代
13.(10分)
(1)有0.06 mol Fe(OH)3沉淀,
(2)0≤x≤0.6 (见下图)
(3)Fe(OH)3的物质的量为A(1-x)mol,
Al(OH)3物质的量为[A(x+3)-0.36]mol
(x取值范围: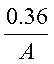 -3≤x≤1)
-3≤x≤1)