《碳族元素》单元检测题
本卷可能用到的相对原子质量:H 1 O 16 Ca 40 C 12
一、选择题(下列每小题只有一个选项符合题意,每小题3分,共48分。)
1.下列气态氢化物中最不稳定的是
A.CH4 B.SiH4 C.H2O D.HCl
2.下列说法中,正确的是
A.碳是非金属元素,所以碳单质都是绝缘体 B.锗不存在气态氢化物
C.硅的导电性介于金属和绝缘体之间 D.锗的非金属性比金属性强
3.去味剂可以消除冰箱里的一股特殊气味,下列物质可以做去味剂的是
A.干冰 B.活性炭 C.氯气 D.二氧化碳
4.下列说法中,正确的是
A.以共价键相结合形成的化合物种类最多的元素是碳
B.某物质只含有一种元素,则该物质一定是纯净物
C.大气污染物中,能与人体血红蛋白结合而引起中毒的气体只有CO
D.金刚石、石墨、C60都是碳的同素异形体,性质完全相同
5.下列关于碳族元素及其化合物的性质描述不正确的是
A.除Pb外,+4价化合物是稳定的 B.RO和RO2(除CO2外)均不跟水反应
C.RH4的稳定性随着相对分子质量的增大而增大 D.RH4的沸点从碳到铅逐渐升高
6.在下列物质中,常温下不与CO2反应的是
(1)H2;(2)KOH;(3)K2O2;(4)K2SiO3溶液;(5)KCl溶液;(6)K2CO3溶液
A. (1)(4)(6) B. (1)(3)(4)(6) C. (2)(3)(4)(6) D. (1)(5)
7.往Na2CO3溶液中加入下列物质,能发生反应但看不到现象的是 A.Ca(OH)2溶液 B. Na2O2固体 C. 盐酸 D. 通入CO2
8纯净的Ca(HCO3)2 试样在高温下分解,当剩余的固体物质质量为原试样质量的一半时,Ca(HCO3)2的分解率是 ( )
A. 50% B. 75% C. 92.7% D. 100%
9.向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量是
(1) .0.001mol (2) .0.002mol (3) .0.003mol (3) .0.004mol
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
10. 石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨 ( )
A.有放射性 B.易燃、易爆 C.能导电 D.有剧毒
11.下列离子方程式正确的是 ( )
A. 碳酸氢钙溶液中加盐酸:HCO3-+H+==CO2↑+H2O
B. 碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O
C. 稀硫酸和氢氧化钡溶液:Ba2++SO42-==BaSO4↓
D. 水玻璃中通入过量二氧化碳:SiO32-+CO2+2H2O==CO32-+H4SiO4↓
12.密闭容器中充入CO2和CO的混合气体,混合气体的平均相对分子质量为32,容器内压强为P,然后投入足量Na2O2,不断用电火花点燃至反应停止,恢复到原温度,容器内的压强为 ( )
A. P B. ![]() P
C.
P
C. ![]() P
D.
P
D. ![]() P
P
13.下列反应中,水既不是氧化剂又不是还原剂,但属于氧化还原反应的是 ( )
A. 2F2+2H2O==4HF+O2
B. P2O5+3H2O![]() 2H3PO4
2H3PO4
C. 3NO2+H2O==2HNO3+NO D. Si+2NaOH+H2O==Na2SiO3+2H2↑
14.科学家预测114号元素为“类铅”,属于第七周期IVA族,下列有关它的性质预测中,肯定错误的是 ( )
A. 它具有+2、+4价,且以+2价稳定
B. 单质的硬度小,熔点低
C. 将铜放入其硝酸盐溶液中会析出“类铅”单质
D. 是放射性元素
15.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.1molCO2,推断杂质的组成可能是 ( )
(1) .KHCO3和MgCO3 (2) .K2CO3和Na2CO3
.(3) .MgCO3和SiO2 (4) .Na2CO3和NaHCO3
A.(3)(4) B.(1)(2)(3) C.(2)(3)(4) D.(1)(3)
16.将过量的CO2通入下列溶液中,最终出现沉淀的是 ( )
(1) .CaCl2溶液 (2) .石灰水 (3) .饱和Na2CO3 (4) .水玻璃
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
 二、实验题
二、实验题
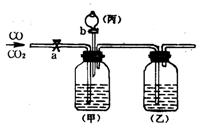
17.要分离一氧化碳、二氧化碳并分别得到干燥的
气体,某学生设计如右图装置,其中a、b是玻璃活塞。
⑴甲容器中盛______溶液;乙容器中盛_____溶液;
丙容器中盛_______溶液。
⑵实验时关闭_____(a、b),打开______(a、b),发生
反应的化学方程式是________________________,
这样得到的气体是__________________。
⑶当分离完一种气体后,关闭___,打开_____,发生反应的化学方程式是___________
_____________________________,这样得到的气体是______________。
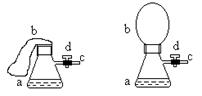 18.图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
18.图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为W2克.则W2和W1的关系是 .
(2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是 .
![]()
不再溶解.此时瓶内温度 (填"不变"、"降低"或"升高").
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式 .
二、填空题
19.已知A、B、C三元素均为短周期元素.且它们的原子序数间的关系符合:A<B<C.A元素原子的最外层电子数为次外层电子数的两倍.B与C可形成BC4型化合物.用元素符号和化学式回答:
(1)A是 ,B是 ,C是
(2)它们的最高价氧化物对应的水化物分别是 、 、 ,其中酸性最弱的是 .
20.人类很早发现孔雀石[主要成分是Cu2(OH)2CO3]在森林燃烧后,余烬中有一种红色光亮的金属产生,试用化学方程式表示孔雀石变化的两个过程。
⑴__________________________________,⑵__________________________________。
21.Fe3O4可以写成FeO·Fe2O3,若看作一种盐时,又可写成Fe(FeO2)2。根据化合价规律和这种书写方法,若将Pb3O4用上述氧化物形式表示,其化学式可写成___________;看成盐可写成___________。等物质的量的Fe3O4和Pb3O4可以分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将盐酸氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式:
Fe3O4+HCl:_____________________________________________________,
Pb3O4+HCl:_____________________________________________________。
22.有一种黑色粉末A在纯氧中充分燃烧生成气体B,加入少量澄清石灰水,出现白色沉淀C,振荡后沉淀消失得溶液D,把D分成两份,一份中加入稀HCl,又生成气体B,另一份加入NaOH溶液又得沉淀C。则A、B、C、D的名称依次为____________、___________、____________、____________。有关的离子方程式为:
B→C_________________________________________________________,
C→D_________________________________________________________,
D→B_________________________________________________________,
D→C_________________________________________________________。
四、计算题(共8分)
23.第四主族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1) 试求n和m的值。
(2) 试求R的相对原子质量。
参考答案:
1、B 2、C 3、B 4、A 5、B 6、D 7、D 8、D 9、D 10、C 11、A
12、D 13、C 14、C 15、A 16、C
17、⑴氢氧化钠溶液(符合题意的其它物质均可,下同) 浓硫酸 稀硫酸 ⑵b a
CO2+NaOH==Na2CO3 一氧化碳 ⑶a b Na2CO3+H2SO4==Na2SO4+CO2↑+H2O 二氧化碳
18、(1)w2=w1(或回答相等) (2)Ca(OH)2+2HCl=CaCl2+2H2O (3)升高
(4)2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O
19、(1)C、Si、Cl(2)H2CO3、H2SiO3、HClO4、H2SiO3
20、⑴Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ⑵2CuO+C
2CuO+CO2↑+H2O ⑵2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
21、2PbO·PbO2;Pb2(PbO4) Fe3O4+8HCl==FeCl2+2FeCl3+4H2O
Pb3O4+8HCl==3PbCl2+Cl2↑+4H2O
22、碳、二氧化碳、碳酸钙、碳酸氢钙 CO2+Ca2++2OH-==CaCO3↓+H2O
CaCO3+CO2+H2O==Ca2++2HCO3- HCO3-+H+==CO2↑+H2O HCO3-+OH-==CO32-+H2O
23、解 (1)由质量分数的含义可列方程组:
a : (a+17n)=0.778 ①
a : (a+17m)=0.636 ②
由①和②可解得n:m=1:2
由于R为碳族元素,所以其主要化合价有+2,+4价,即其氢氧化物只有两种形式:R(OH)2和R(OH)4,所以n=2 ,m=4
(3) 将n=2 代入①式,或将m=4代入②式,解得a=119