高考化学第一轮总复习试卷(八)
硅和无机非金属材料
第Ⅰ卷 (选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1、原始大气是还原性的,含![]() 但不含
但不含![]() ,今天地球上的大气却具有氧化性。试推测在还原性大气向氧化性大气转变的过程中,大部分的游离氧来源于
( )
,今天地球上的大气却具有氧化性。试推测在还原性大气向氧化性大气转变的过程中,大部分的游离氧来源于
( )
A.大量的火山喷发
B.强紫外线使水分解而释放出![]() 和
和![]()
C.远古时代绿色植物的光合作用
D.火山熔岩流入水体中,使水在高温下分解
2、以下说法正确的是 ( )
A.纳米材料是一种称为“纳米”的新物质制成的材料
B.绿色食品是指不含任何化学物质的食品
C.生物固氮是指植物通过叶面直接吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
3、下列物质有固定熔点的是( )
A.钢化玻璃 B.过磷酸钙 C.消石灰 D.水玻璃
4、绿柱石又称为绿宝石,其主要成分为![]() ,也可以用二氧化硅和金属氧化物的形式表示,则n为( )
,也可以用二氧化硅和金属氧化物的形式表示,则n为( )
A.1 B.2 C.3 D.4
5、下列叙述中的四种非金属元素,所形成的气态氢化物的稳定性最差的是( )
A.构成矿物质和岩石的主要元素
B.形成化合物种类最多的元素
C.空气中质量分数最高的元素
D.单质在常温下呈液态的元素
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6、最近,科学家研究制得一种新的分子![]() ,它具有空心的类似足球状的结构,下列关于
,它具有空心的类似足球状的结构,下列关于![]() 的说法错误的是( )
的说法错误的是( )
A.![]() 是由60个碳原子构成的分子,相对分子质量是720
是由60个碳原子构成的分子,相对分子质量是720
B.![]() 、石墨、金刚石都是碳的同分异构体
、石墨、金刚石都是碳的同分异构体
C.![]() 是一种新型的化合物,粒子间存在范德华力
是一种新型的化合物,粒子间存在范德华力
D.![]() 将在超导、材料科学等领域有重要的应用价值
将在超导、材料科学等领域有重要的应用价值
7、工业上制取金刚砂的化学反应方程式如下:![]() 。在这个氧化还原反应中,氧化剂和还原剂物质的量之比为( )
。在这个氧化还原反应中,氧化剂和还原剂物质的量之比为( )
A.1:2 B.2:1 C.5:3 D.3:5
8、下列离子方程式不正确是( )
A.石英与烧碱溶液反应![]()
B.向澄清的石灰水中通入过量的![]()
![]()
C.向小苏打溶液中加入过量的石灰水
![]()
D.向水玻璃中加入过量盐酸
![]()
9、下列说法摘自某科普杂志,你认为无科学性错误的是( )
A.铅笔芯的原料是重金属铅,儿童在使用时不可能用嘴吮咬铅笔,以免引起铅中毒
B.一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用
D.硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂”
10、将二氧化碳通入下列物质的溶液中不与其反应的是( )
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]()
⑦![]()
A.①③④⑤⑥ B.①⑥ C.① D.⑥
11、下列盛放试剂的方法正确的是( )
A.氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中
B.汽油或煤油放存放在带橡皮塞的棕色玻璃瓶中
C.碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
12、纯净的碳酸氢钙试样在高温下分解,当剩余固体质量为原试样质量的一半时,碳酸氢钙的分解率是 ( )
A.50% B.75% C.92.7% D100%.
13、第三周期元素R,它的原子核外最外层达到饱和所需电子数是最内层电子数的正整数倍,且小于次处层电子数的![]() ,则关于R的判断正确的是( )
,则关于R的判断正确的是( )
A.常温时,能稳定存在的R的氧化物都能与烧碱溶液反应
B.R的最高正价氧化物对应的水化物为强酸
C.R的单质在固态时,均属于分子晶体
D.R的气态氢化物在常温下都能稳定存在
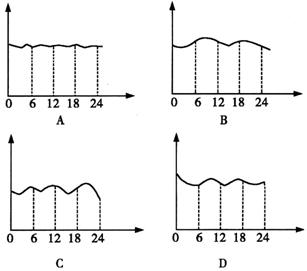
14、下面是某环境监测兴趣小组的同学描绘的南京市中心新街口地区空气中![]() 含量变化曲线,横坐标表示北京时间0时到24时,纵坐标表示CO含量,你认为比较符合实际的是( )
含量变化曲线,横坐标表示北京时间0时到24时,纵坐标表示CO含量,你认为比较符合实际的是( )
15、请据图8-1回答,经数小时后,U形管A、B两处的液面会出现下列哪种情况?(实验装置里的空气足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响) ( )
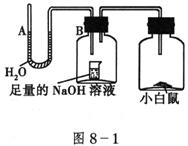
A.A处上升,B处下降
B.A、B两处都下降
C.A处下降,B处上升
D.A、B两处都不变
第Ⅱ卷 (非选择题 共90分)
三、(本题包括2小题,共20分)
16、(8分)在没有现成的![]() 气体发生器的情况下,请你选用图8-2中的部分仪器,装配成一个简易并且能随用、随关、随停的
气体发生器的情况下,请你选用图8-2中的部分仪器,装配成一个简易并且能随用、随关、随停的![]() 气体发生装置。
气体发生装置。
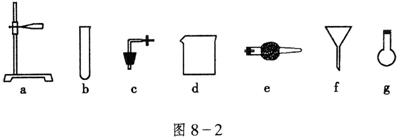
(1)应用的仪器是_________(填入仪器的编号)。
(2)若用上述装置制取![]() 气体,而实验室只有稀
气体,而实验室只有稀![]() 、浓
、浓![]() 、水、纯碱、块状石灰,比较合理的方案应选用的药品是_________。
、水、纯碱、块状石灰,比较合理的方案应选用的药品是_________。
17、(12分)在半导体工业中,有一道工序叫烧氢。烧氢的工艺流程如图8-3所示。工作时,是将石英管D出口处氢气点燃。半导体硅片、焊片和金属零件从石英管口送入加热区,在氢气还原气氛中加热使焊片熔化,将单晶硅与金属零件焊接在一起。焊接后再将零件拉至冷却区,冷却后取出。烧氢工艺中的氢气纯度要求极高,工业氢气虽含氢量达99.9%,但仍含有极微量的水蒸气和氧气,所以点燃氢气前应检验氢气的纯度。试回答下列问题。
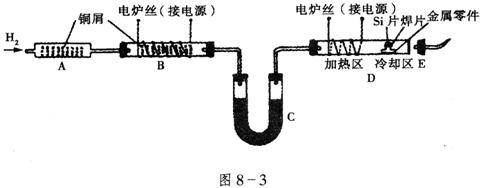
(1)装置B的作用是__________________;B中发生反应的化学方程式是___________。
(2)装置C中的物质是__________;C的作用是___________。
(3)点燃氢气前将E(带导管胶塞)接在D的出口处,目的是___________________。
(4)装置A是安全瓶,可以防止氢气燃烧回火,引起爆炸,其中填充大量纯铜屑的作用是___________________。
四、(本题包括3小题,共31分)
18、(9分)(1)绿色植物可以通过________作用吸收![]() ,可以通过________作用将
,可以通过________作用将![]() 释放到大气中。
释放到大气中。
(2)人类活动可以由多种途径增加大气中的![]() ,请写出下列会产生
,请写出下列会产生![]() 的化学方程式。
的化学方程式。
①石灰窑生产石灰__________;
②煤炭燃烧________________;
③汽油燃烧________________;
19、(12分)锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素有强还原性,+4价铅元素的化合物有强氧化性,例如:![]() 还原性比
还原性比![]() 还原性强,
还原性强,![]() 的氧化性比
的氧化性比![]() 的氧化性强,根据以上的叙述,回答有关的问题:
的氧化性强,根据以上的叙述,回答有关的问题:
(1)写出下列反应的化学方程式:
①氯气与锡共热______________;
②氯气与铅共热______________;
③![]() 与浓盐酸共热_________________。
与浓盐酸共热_________________。
(2)能说明![]() 还原性比
还原性比![]() 还原性强的离子方程式为______________________________
还原性强的离子方程式为______________________________
(3)![]() 可以写成
可以写成![]() ,若把它看作一种盐时,又可写成
,若把它看作一种盐时,又可写成![]() 。据化合价规律和这种书写方法,可将
。据化合价规律和这种书写方法,可将![]() 用上述氧化物形式表示,其化学式可写成________,若看成盐时可写成________。
用上述氧化物形式表示,其化学式可写成________,若看成盐时可写成________。
20.(10分)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
(1)根据性质,推测氮化硅属于________晶体。
(2)根据性质,推测氮化硅陶瓷的用途是_________(填序号)。
A.制汽轮机叶子 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(3)根据化合价规律,推测氮化硅的化学式为_________。
(4)氮化硅陶瓷抗腐蚀性强,除氢氟酸外,它不与其他无机酸反应。试写出该陶瓷被氢氟酸腐蚀的化学方程式_____________。
(5)现用四氯化硅和氮气在氢气保护下加强热反应,可得较高纯度的氮化硅,反应的化学方程式为____________________。
五、(本题包括2小题,共22分)
21.(10分)由主要成分是碳酸钡、碳酸钙组成的矿石样品,某课处活动小组欲从该样品中分离出碳酸钡,尽可能除去![]() 。供实验参考的数据见下表。
。供实验参考的数据见下表。
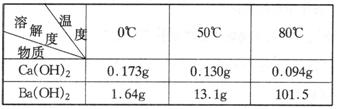
分离要求:原料是矿石;试剂只有水,不能再用其他试剂;要求将矿石经四步反应或操作后得到较纯净的碳酸钡(如图8-4所示)。
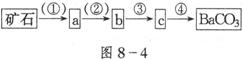
试回答下列问题:
(1)在括号中填入实验的条件或方式:①________;②________。
(2)在方框中填入对应物质的化学式:a_________;b_________。
(3)写出有关反应的化学方程式。
![]() :______________________;
:______________________;
![]() :_________________。
:_________________。
22.(12分)材料科学是近年来与化学有关的科学研究的热点。某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性。它是以中学化学中的常见物质为原料来生产的,图8-5虚线框外为其生产过程;线框内的其它转化是为探究C的组成而设,G、F、H均为难溶于水的白色固体;图中C、M、K均含A元素,其余物质均为中学化学中常见的物质。
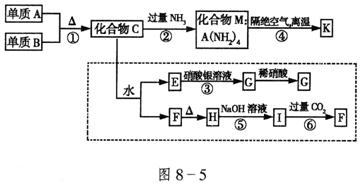
请回答下列问题:
(1)指出K可能所属的晶体类型_______,K晶体中A原子周围化学键的键角均相等,键角值为_______。
(2)写出化学式,化合物C_______,化合物F_______。
(3)写出反应的离子反应方程式:③__________;⑤__________。
(4)写出反应④的化学方程式___________。
六、(本题包括2小题,共17分)
23.(8分)在25℃时,![]() 条件下,将
条件下,将![]() 通入
通入![]() 和
和![]() 的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和![]() 的混合气中V(CO)=__________L,
的混合气中V(CO)=__________L,![]() ___________L。
___________L。
(2)若剩余气体的体积是aL,则原CO和![]() 的混合气中
的混合气中![]() _________。
_________。
(3)若剩余气体的体积是aL,则a的取值范围是___________。
24、(9分)将W g木炭与![]() 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为![]() ,高温下容器中木炭与
,高温下容器中木炭与![]() 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为![]() ,试求:
,试求:
(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以![]() 表示)是______。
表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
(3)在题设条件下,W、a、P、![]() 之间必须满足函数系W=f(a、
之间必须满足函数系W=f(a、![]() 、P),写出该函数表达式:__________________。
、P),写出该函数表达式:__________________。
参考答案
1.C 植物的光合作用吸收![]() 放出
放出![]() 。
。
2.D 纳米(nm)是一长度单位;污染少或无污染的食品称绿色食品;生物固氮通过根瘤菌进行。
3.C 纯净物才有固定熔沸点,水玻璃是![]() 的水溶液。
的水溶液。
4.C 依改写规则![]() 可写成
可写成![]()
5.A 四种非金属元素依次为Si、C、N、Br,非金属性最差的是Si。
6.BC ![]() 是由碳原子构成的分子,它与石墨、金刚石互称为同素异形体。
是由碳原子构成的分子,它与石墨、金刚石互称为同素异形体。
7.A 在![]() 中,2C原子被氧化作还原剂,一个C原子被还原作氧化剂。
中,2C原子被氧化作还原剂,一个C原子被还原作氧化剂。
8.C ![]() (少定)、
(少定)、![]() (多变),中和一个
(多变),中和一个![]() 只需一个
只需一个![]() 。
。
9.CD 铅笔芯的原料是石墨;水不能吸收CO(CO不溶于水,常温下也不与水反应)。
10.D ②③④⑤发生“强酸制弱酸”反应,①⑦生成![]() 而反应。
而反应。
11.D HF腐蚀玻璃;浓硝酸、汽油、煤油腐蚀橡皮;碱性溶液可与![]() 作用生成
作用生成![]() 使瓶塞与瓶口粘结。
使瓶塞与瓶口粘结。
12.D ![]() ,剩余固体
,剩余固体![]() 大于原试样质量的一半,需再发生
大于原试样质量的一半,需再发生![]() ,即
,即![]() 全部分解。
全部分解。
13.A R最外层达饱和所需电子数可能为2、4或6;又因小于![]() ,故R可能是
,故R可能是![]() 或S。
或S。
14.B CO主要来源于煤、石油及含碳元素的物质的燃烧和汽车尾气的排放,根据人们的活动规律,早晨和晚上CO含量应较低。
15.C 小白鼠吸收容器中的氧气,呼出![]() ,被集气瓶中的
,被集气瓶中的![]() 吸收,造成集气瓶中压强(两集气瓶是连通的,压强相等)减小,所以U形和B处液面上升,A处液面下降。
吸收,造成集气瓶中压强(两集气瓶是连通的,压强相等)减小,所以U形和B处液面上升,A处液面下降。
16.(1)a,c,d,e (2)水、浓![]() 、块状石灰石
、块状石灰石
17.(1)除去氧气;![]() ,
,![]()
(2)无水![]() (或碱石灰);吸收水蒸气 (3)检验氢气纯度
(或碱石灰);吸收水蒸气 (3)检验氢气纯度
(4)大量的铜屑可以吸收热量,降低温度
18.(1)光合;呼吸 (2)①![]()
②![]()
③![]()
19.(1)①![]()
②![]()
③![]()
(2)![]()
(3)![]()
20.(1)原子晶体 (2)A、C、D (3)![]()
(4)![]()
(5)![]() (或
(或![]() )
)
21.(1)①高温 ②80℃的![]() (2)
(2)![]() 、
、![]() ;
;![]() 、
、![]()
(3)![]() ,
,![]() ;
;![]()
22.(1)原子晶体;109°28’ (2)![]() ;
;![]() (或
(或![]() )
)
(3)③![]() ⑤
⑤![]()
(4)![]()
23.由反应原理![]() ①得,在同温、同压下CO和
①得,在同温、同压下CO和![]() 的混合气体
的混合气体
![]() ②
②
完全燃烧耗![]() 的体积为混合气体的1/2,即[
的体积为混合气体的1/2,即[![]() ]:
]:
(1)当![]() =10L时,要使其完全燃烧,必须有
=10L时,要使其完全燃烧,必须有![]() 。已知
。已知![]() ,则
,则![]() 过量10L。又因反应后剩余气体的体积是15L,在25℃、101KPa条件下,水的状态为液体,则剩余气体为
过量10L。又因反应后剩余气体的体积是15L,在25℃、101KPa条件下,水的状态为液体,则剩余气体为![]() 和
和![]() 的混合气。故反应生成的二气化碳的体积
的混合气。故反应生成的二气化碳的体积![]() ,则由反应原理①得:
,则由反应原理①得:![]() ,
,![]() =10-V(CO)=5L。
=10-V(CO)=5L。
(2)由题(1)可以推理得:![]() ;依反应原理①有
;依反应原理①有![]() ;
;![]() =10L-(a-10)L =(20-a)L。则
=10L-(a-10)L =(20-a)L。则![]() =(a-10):(20-a)。
=(a-10):(20-a)。
(3)由题(2)结论有:(a-10):(20-a)>0;即a-10>0,20-a>0,所以10 <a< 20。
24.(1)![]() (2)
(2)![]() ; (3)
; (3)![]()