高考化学第一轮总复习试卷(九)
氮族元素
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中 C.放入盐酸中 D.观察外观
2.下列物质存放方法正确的是( )
A.药品柜的同一层不可存放浓硝酸和浓氨水
B.少量的钠保存在无水乙醇中
C.少量白磷保存在二硫化碳中
D.硅酸钠溶液保存在玻璃塞的试剂瓶中
3.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获1998年诺贝尔医学及生理学奖。关于NO的下列叙述不正确的是( )
A.NO可以是某些含低价N物质的氧化产物
B.NO不是亚硝酸酸酐
C.NO可以是某些高价N物质的还原的产物
D.NO是红棕色气体
4.废切削液中含2%~5%的![]() ,直接排放会污染环境,下列试剂中能使其转化为不引起二次污染的
,直接排放会污染环境,下列试剂中能使其转化为不引起二次污染的![]() 的是( )
的是( )
A.![]() B.
B.![]() C.
C.![]() D.浓
D.浓![]()
5.下列反应式表示氨既有还原性又有碱性的是( )
A.![]() B.
B.![]()
C.![]()
D.![]()
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.一氯氨(![]() )中氨基离子带负电荷,预计它跟水反应的最初生成物是( )
)中氨基离子带负电荷,预计它跟水反应的最初生成物是( )
A.![]() 和HCl
B.
和HCl
B.![]() 和HCl
和HCl
C.![]() 和HC1O
D.
和HC1O
D.![]() 和
和![]()
7.图9-1装置可用于( )
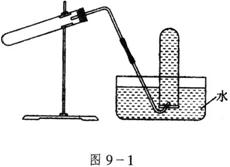
A.加热![]() 制
制![]()
B.用Cu与稀![]() 反应制NO
反应制NO
C.用![]() 和浓NaOH溶液反应制
和浓NaOH溶液反应制![]()
D.用NaCl与浓![]() 反应制HC1
反应制HC1
8.关于磷的下列叙述中,正确的是( )
A.红磷没有毒性而白磷有剧毒
B.白磷在空气中加热到260℃可转变为红磷
C.白磷可用于制造安全火柴
D.少量白磷应保存在水中
9.将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况),则所消耗的硝酸的物质的量是( )
A.0.12mol B.0.11mol C.0.09mol D.0.08mol
10.对下列事实的解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐来贮存,说明铝与浓硝酸不反应
D.反应![]() 能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
11.氢化铵(![]() )
)![]() 结构相似,
结构相似,![]() 和水反应有
和水反应有![]() 生成,下列叙述不正确的是( )
生成,下列叙述不正确的是( )
A.![]() 溶于水时,
溶于水时,![]() 是氧化剂
是氧化剂
B.![]() 溶于水后所形成的溶液显酸性
溶于水后所形成的溶液显酸性
C.![]() 的电子式为:
的电子式为: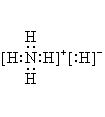
D.![]() 固体溶于水有两种气体生成
固体溶于水有两种气体生成
12.将铜粉放入稀硫酸中,加热无明显反应发生。但加入某盐后,发现铜粉质量逐渐减少,该盐可能是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.下列对硝酸的认识不正确的是( )
A.打开浓硝酸的瓶盖会产生棕色的烟 B.锌跟稀硝酸的反应是置换反应
C.常用硝酸来制炸药、硫酸和化肥 D.稀硝酸也是一种强氧化性酸
14.0.03molCu投入到一定量的浓![]() 中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的
中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的![]() ,恰好使气体完全溶于水,则通入
,恰好使气体完全溶于水,则通入![]() 的体积为( )
的体积为( )
A.504mL B.336mL C.224mL D.168mL
15.化学工业生产尿素的化学反应是( )
![]() ,已知下列物质在一定条件下均能与水反应产生
,已知下列物质在一定条件下均能与水反应产生![]() 和
和![]() ,
,![]() 是合成氨的原料,
是合成氨的原料,![]() 供合成尿素用,若从原料被充分利用的角度考虑,最好选用的原料是( )
供合成尿素用,若从原料被充分利用的角度考虑,最好选用的原料是( )
A.焦炭 B.一氧化碳
C.甲烷 D.石脑油(![]() ,
,![]() )
)
第Ⅱ卷(非选择题 共90分)
三、(本题包括2小题,共32分)
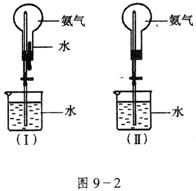
16.(14分)制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式:
______________________________________________________。
(2)收集氨气应使用_________________法,要得到干燥的氨气可选用_________________做干燥剂。
(3)用图9-2(Ⅰ)装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是____________。该实验的原理是____________________。
(4)如果只提供如图9-2(Ⅱ)的装置,请说明引发喷泉的方法。
_______________________________________________________________________。
17.(18分)实验室用稀硝酸与Cu反应来制备NO气体,如果采用图9-3(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的![]() ,不易观察到有无色的NO生成。即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由
,不易观察到有无色的NO生成。即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由![]() 与
与![]() 反应生成的。有人设计了图9-3(Ⅱ)装置,用来做该实验可以达到满意的效果。
反应生成的。有人设计了图9-3(Ⅱ)装置,用来做该实验可以达到满意的效果。
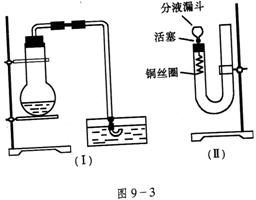
(1)将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到________________________为止。
②关闭活塞,用酒精灯在____________加热,当___________时,立即撤去酒精灯。
(2)回答下列问题:
①写出铜与稀硝酸反应的离子方程式_________________________;
②反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
______________________________________________________________________;
③如果再将活塞慢慢打开,可立即观察到哪些明显现象?
_______________________________________________________________________;
④如果需要再获得NO与已生成的![]() 形成鲜明对照的实验效果,应_______________________(填操作)。
形成鲜明对照的实验效果,应_______________________(填操作)。
四、(本题包括3小题,共27分)
18.(6分)烟幕弹是一种在战争中常用的掩护武器,制造烟幕弹需要用到一些化学物质。
(1)用红磷作烟幕弹时,所对应反应的化学方程式为________________________;
(2)有些烟幕弹产生烟幕的原理应用了水解反应。水解反应是一种广泛存在的反应,如![]() 、
、![]() 易水解,
易水解,![]() 的水解反应为
的水解反应为![]() 。现代海战中,常常通过喷放
。现代海战中,常常通过喷放![]() 和液氨产生大量烟幕,所涉及反应的化学方程式为_______________________________________。
和液氨产生大量烟幕,所涉及反应的化学方程式为_______________________________________。
19.(8分)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者成绿色,后者呈蓝色,某同学提出这可能是![]() 浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是
浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是![]() 与
与![]() 混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
20.(13分)某生态系统中氮循环简图如图9-4所示
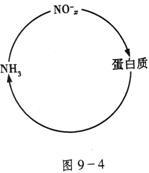
(1)哪一类生物能将蛋白质转化为氨?
A.分解者
B.藻类
C.化能合成类生物
(2)该生态系统的豆科植物不施氮肥,仍能表现出良好的长势,其原因是_______________________________________________。
(3)写出工业固氮的化学反应方程式__________________________。
(4)雷雨中常会有微量的硝酸生成为农作物所利用,用化学方程式解释![]() 的形成过程:________________________________________________________。
的形成过程:________________________________________________________。
(5)硝化细菌能将![]() 氧化为亚硝酸和硝酸,写出有关的化学反应方程式:________________________________________。
氧化为亚硝酸和硝酸,写出有关的化学反应方程式:________________________________________。
五、(本题包括2小题,共16分)
21.(8分)如图9-5所示,已知
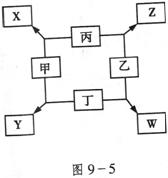
①甲、乙 、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是______________,乙是______________。
(2)甲与丙反应生成X的化学方程式是___________________________。
(3)乙与丁反应生成W的化学方程式是___________________________。
22.(8分)氨可以形成多种离子,如![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,已知
等,已知![]() 与
与![]() 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于![]() 的性质。
的性质。
(1)1个![]() 离子含有____________个电子,
离子含有____________个电子,![]() 的电子式为______________。
的电子式为______________。
(2)形成![]() 离子的中性分子的结构式是__________________。
离子的中性分子的结构式是__________________。
(3)写出![]() 离子在强碱溶液中反应的离子方程式____________________________________。
离子在强碱溶液中反应的离子方程式____________________________________。
六、(本题包括2小题,共15分)
23.(5分)已知氮的氧化物跟NaOH溶液发生的反应如下:
![]()
S![]()
现有m mol的![]() 和n molNO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为
和n molNO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为![]() 的NaOH溶液,求需此NaOH溶液的体积是多少?
的NaOH溶液,求需此NaOH溶液的体积是多少?
24.(10分)将23.9g表面已锈蚀成铜绿![]() 的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成
的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成![]() 和NO,反应后溶液中
和NO,反应后溶液中![]() 为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数;
(2)铜片与硝酸充分反应后,溶液中![]() 的物质的量浓度(假设反应前溶液的体积不变)。
的物质的量浓度(假设反应前溶液的体积不变)。
参考答案
1.D 铜锌合金也称黄铜,其外观与黄金相似,但其密度比黄金小,因其含有锌单质,放入硝酸、盐酸中都能反应,而黄金不与硝酸、盐酸反应。
2.A 浓硝酸和浓氨水均有挥发性,二者生成的![]() 有爆炸性。
有爆炸性。
3.D 在NO分子中,N元素呈+2价,它既可以是含低价N物质被氧化的产物,又可以是含高价N物质被还原的产物。两个分子的亚硝酸![]() 失水得
失水得![]() 而不是NO,故
而不是NO,故![]() 可认为是亚硝酐。NO是无色气体,
可认为是亚硝酐。NO是无色气体,![]() 才是红棕色气体。
才是红棕色气体。
4.B ![]() 与
与![]() 发生归中反应生成
发生归中反应生成![]() 。
。
5.C 生成![]() 表现还原性,生成
表现还原性,生成![]() 表现酸性。
表现酸性。
6.C 由题给信息,![]() 结合
结合![]() 、
、![]() 结合
结合![]() 。
。
7.B 4个选项中,选项A不对,因为![]() 热分解产生的水会在试管口凝结,从而沿管壁落入热的试管底造成试管炸裂。
热分解产生的水会在试管口凝结,从而沿管壁落入热的试管底造成试管炸裂。![]() 和HCl气体都易溶于水,不能用排水法收集。
和HCl气体都易溶于水,不能用排水法收集。
8.AD 白磷有毒,红磷无毒,白磷着火点很低,在空气中加热极易燃烧,被氧化。
9.B 消耗的硝酸的物质的量=![]() 。
。
10.C Fe、Al块被氧化膜覆盖,并不是铝与浓硝酸不反应。浓硝酸易分解,产生的![]() 溶解其中溶液呈黄色。
溶解其中溶液呈黄色。
11.AB 因![]() 的结构与
的结构与![]() 相似,故选项C是正确的。再由
相似,故选项C是正确的。再由![]() 与水反应的方程式:
与水反应的方程式:
![]() 可知:反应后溶液应呈碱性,并有
可知:反应后溶液应呈碱性,并有![]() 放出,同时又会放出部分
放出,同时又会放出部分![]() ,在该反应中
,在该反应中![]() 中的
中的![]() 失电子,所以
失电子,所以![]() 为还原剂。
为还原剂。
12.AC 加入![]() 时,
时,![]() ;铜粉溶解,加入
;铜粉溶解,加入![]() 时溶液中有
时溶液中有![]() 使Cu溶解。
使Cu溶解。
13.AB 浓![]() 易挥发打开瓶盖有白雾;稀
易挥发打开瓶盖有白雾;稀![]() 与Zn发生氧化还原反应。
与Zn发生氧化还原反应。
14.B 依终态法,发生的总反应为
![]()
![]() 得:
得: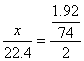 ,
,![]()
15.D 依![]() ,则
,则![]() 与
与![]() 的体积比1:3时为最佳。分别写出四种物质与水反应的化学方程式,比较石脑油为最佳,如
的体积比1:3时为最佳。分别写出四种物质与水反应的化学方程式,比较石脑油为最佳,如![]()
![]()
16.(1)![]()
(2)向下排空气;碱石灰
(3)打开止水夹,挤出胶头滴管中的水;氨气极易溶于水,致使烧瓶内气体压强迅速减小
(4)打开夹子,用手(或热手巾等)将烧瓶捂热,空气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉
17.(1)①液面接触分液漏斗活塞下沿 ②U型管的短管一侧(或者答“U型管的左管”);铜丝圈有气泡产生(2)①![]() ②铜丝圈与稀
②铜丝圈与稀![]() 脱离后立即停止,U型管短管内(铜丝圈周围)可以观察到无色的NO气体 ③U型管的长管中的稀
脱离后立即停止,U型管短管内(铜丝圈周围)可以观察到无色的NO气体 ③U型管的长管中的稀![]() 又回落到短管内,分液漏斗中有红棕色出现 ④关闭分液漏斗活塞并适当加热。
又回落到短管内,分液漏斗中有红棕色出现 ④关闭分液漏斗活塞并适当加热。
18.(1)![]()
(2)![]()
19.不同意;铜片质量相同,溶液体积相同,生成的![]() 浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色
浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色
20.(1)A (2)根瘤菌将游离的氮转化为化合态的氮,满足豆科植物的营养需要
(3)![]()
(4)![]() ,
,![]() ,
,![]()
(5)![]() ,
,![]()
21.(1)![]() ;
;![]() (2)
(2)![]() (3)
(3)![]()
或![]() (3)
(3)![]()
22.(1)22;![]() (2)
(2)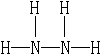
(3)![]()
23.因氮的氧化物与NaOH反应生成![]() 和
和![]() ,由N原子守恒可知,其物质的量为
,由N原子守恒可知,其物质的量为![]()
则![]()
![]()
24.分析: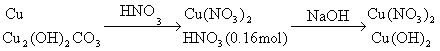
![]()
设铜片中含铜为xmol,含![]() 为ymol,有
为ymol,有
![]()
(1)
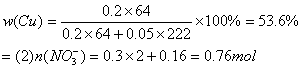
(2)![]()