高考化学第一轮总复习试卷(十一)
电离平衡
第Ⅰ卷 (选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
2.为维持人体内电解质平衡,下列离子在人体大量出汗后应及时补充的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
A.![]()
B.![]()
C.![]()
D.无法确定![]() 与
与![]() 的关系
的关系
4.在同一温度下,弱电解质溶液a,弱电解质溶液b,金属导体c的导电能力相同。若升高温度后,它们的导电能力是( )
A.a>b>c B.a=b=c C.c>a>b D.b>c>a
5.等物质的量浓度的下列溶液中,![]() 离子的浓度最大的是( )
离子的浓度最大的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.从下列现象可以判断某酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以分解石灰石放出![]()
C.该酸可以把![]() 沉淀溶解
沉淀溶解
D.该酸浓度为![]() 时的pH为1
时的pH为1
7.常温下,某溶液中,由水电离出的氢离子的物质的量浓度为![]() ,该离子中可能大量共存的离子组是( )
,该离子中可能大量共存的离子组是( )
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
8.下列现象或应用不能用胶体知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥治金厂常用高压电除去工厂烟尘,减少对空气污染
9.实验测得常温下![]() 某一元酸(HA)溶液的pH不等于1,
某一元酸(HA)溶液的pH不等于1,![]() 某一元碱(BOH)溶液里
某一元碱(BOH)溶液里![]() ,将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度由大到小顺序是( )
,将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度由大到小顺序是( )
A.![]()
B.![]()
C.![]()
D.![]()
10.以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,现用![]() 溶液滴定浓度相近的甲酸时,上述指示剂( )
溶液滴定浓度相近的甲酸时,上述指示剂( )
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
11.下列离子方程式书写正确的是( )
A.醋酸除水垢 ![]()
B.盐酸除铁锈 ![]()
C.硫酸除铜绿 ![]()
D.(稀)硝酸除银镜 ![]()
12.用水稀释![]() 氨水时,溶液中随着水量的增加而减小的是( )
氨水时,溶液中随着水量的增加而减小的是( )
A.![]() B.
B.![]()
C.![]() 和
和![]() 的乘积
D.
的乘积
D.![]() 的物质的量
的物质的量
13.将20 mL ![]() 硝酸铵溶液跟50 mL
硝酸铵溶液跟50 mL ![]() 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是(
)
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是(
)
A.![]()
B.![]()
C.![]()
D.![]()
14.某溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() 等4种阴离子,若向其中加入足量的
等4种阴离子,若向其中加入足量的![]() 后,溶液中离子浓度变化最小的是( )
后,溶液中离子浓度变化最小的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.用已知浓度的NaOH溶液测定某![]() 溶液的浓度,如11-1图,从下表中选出正确选项( )
溶液的浓度,如11-1图,从下表中选出正确选项( )
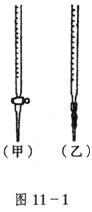
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
第Ⅱ卷 (非选择题 共90分)
三、(本题包括2小题,共18分)
16.(6分)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标出仪器使用温度的是________________(填写编号);
(2)能够用以精确量取液体体积的是_____________(填写编号);
(3)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为__________________g。
17.(12分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明乙酸是弱酸,药品是冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
(1)设计的理论依据是__________________________________________;
(2)实验简要步骤是______________________________________________________
_____________________________________________________________;
(3)需记录的现象和数据是_______________________________________;
(4)推断与分析,由于__________________________________________;说明_________________________________________________,所以乙酸是弱酸。
四、(本题包括3小题,共26分)
18.(8分)在盛有碳酸钠浓溶液的试管中逐滴加入稀盐酸,充分振荡,直到不再产生![]() 气体为止,则在此过程中,溶液里
气体为止,则在此过程中,溶液里![]() 离子浓度的变化趋势可能是___________________
离子浓度的变化趋势可能是___________________
A.逐渐增大 B.逐渐减小
C.先逐渐增大,而后逐渐减小 D.先逐渐减小,而后逐渐增大
试用方程式和简要文字表述理由:
_________________________________________________________________________________________________________________________
19.(8分)泡沫式灭火器内盛放![]() 溶液(约
溶液(约![]() )、
)、![]() 溶液(约
溶液(约![]() )及起泡剂。使用时发生的化学方程式是______________________________,
)及起泡剂。使用时发生的化学方程式是______________________________,![]() 溶液和
溶液和![]() 溶液的体积比约是_______________。若用等体积等物质的量浓度的
溶液的体积比约是_______________。若用等体积等物质的量浓度的![]() 溶液代替
溶液代替![]() 溶液,在使用时喷不出泡沫,这是因为_________________。泡沫灭火器玻璃筒里盛放
溶液,在使用时喷不出泡沫,这是因为_________________。泡沫灭火器玻璃筒里盛放![]() 溶液,铁筒里存放
溶液,铁筒里存放![]() 溶液,不能把
溶液,不能把![]() 溶液盛放在铁筒里的原因是______________________________。
溶液盛放在铁筒里的原因是______________________________。
20.(10分)25℃时,若体积为![]() 、pH=a的某一元强酸与体积为
、pH=a的某一元强酸与体积为![]() 、pH=b的某一元强碱混合,恰好中和,且已知
、pH=b的某一元强碱混合,恰好中和,且已知![]() 和a=0.5b,请填写下列空白:
和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)______________,其理由是__________________
____________________________。
(2)a值可否等于5(填“可”或“否”)___________,其理由是_____________________
__________________________________________。
(3)试确定a的取值范围_________________________________。
五、(本题包括2小题,共20分)
21.(12分)取体积相同(0.025L)的两份![]() 溶液,把其中的一份放在空气中一段时间后,溶液的pH_________________(填“增大”、“减小”或“不变”),其原因是____________________________________________。
溶液,把其中的一份放在空气中一段时间后,溶液的pH_________________(填“增大”、“减小”或“不变”),其原因是____________________________________________。
用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为![]() ,另一份消耗硫酸溶液的体积为
,另一份消耗硫酸溶液的体积为![]() ,则:
,则:
(1)以甲基橙为指示剂时,![]() 与
与![]() 的关系是____________________________;
的关系是____________________________;
(2)以酚酞为指示剂时,![]() 与
与![]() 的关系是____________________________。
的关系是____________________________。
22.(8分)有A、B、C、D四种无色溶液,它们分别是![]() 溶液、
溶液、![]() 溶液、盐酸和
溶液、盐酸和![]() 溶液中的一种。
溶液中的一种。
(1)已知A、B的溶液中水的电离程度相同,A、C溶液和pH相同。A是____________溶液,B是______________溶液,C是_______________溶液。
(2)若B溶液中![]() 与C溶液中的
与C溶液中的![]() 相同,现将B的溶液稀释10倍后溶液的pH值用
相同,现将B的溶液稀释10倍后溶液的pH值用![]() 表示,C溶液的pH值用
表示,C溶液的pH值用![]() 表示,则
表示,则![]() __________________(填大于或等于某个数)。
__________________(填大于或等于某个数)。
六、(本题包括2小题,共26分)
23.(9分)有一种pH为12的NaOH溶液100 mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加____________mL;(溶液总体积允许相加。下同)
(2)如果加入pH=10的NaOH溶液,应加______________mL;
(3)如果加入![]() 的盐酸,应加__________________mL。
的盐酸,应加__________________mL。
24.(17分)实验室为测定某工业废水中含酚(以苯酚计)量,进行如下操作:
(1)分别称取![]() 和
和![]() ,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
,混合后置于烧杯中,加蒸馏水使其溶解。用________________(填仪器名称不同)引流注入_____________,……最后用___________滴加蒸馏水定容,配成1L溶液。
(2)称取_____________![]() ,用同样方法准确配制
,用同样方法准确配制![]() 的标准溶液。
的标准溶液。
(3)准确量取100mL含酚(以苯酚计)水样,准确滴加![]() 混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成
混合液15.00mL并加适量盐酸将水样酸化。此时两种钾盐反应生成![]() ,立即跟苯酚反应生成沉淀。
,立即跟苯酚反应生成沉淀。
(4)上述反应完成后,再加入约1 g KI,放置5 min,然后用_____________作指示剂,再用![]() 标准溶液滴定至蓝色恰好消失为止(反应为:
标准溶液滴定至蓝色恰好消失为止(反应为:![]() ),用去
),用去![]() 溶液。
溶液。
(5)求水中酚的含量(![]() )是否符合国家有关废水允许排放的标准?
)是否符合国家有关废水允许排放的标准?
(国家标准为酸的含量≤![]() )
)
参考答案
1.D 雾是由小水珠(直径![]() )分散于空气中形成的,属于胶体。
)分散于空气中形成的,属于胶体。
2.C 人体出汗时会损失NaCl,需补充![]() 。
。
3.C 据电荷守恒![]() ,
,![]() ,
,![]() ,则
,则![]() 。
。
4.A 温度升高,弱电解质的电离程度增大,导电能力增强;强电解质因已完全电离,导电能力变化不大;而金属的导电能力减弱。
5.C 在![]() 溶液中,
溶液中,![]() ,
,![]() 的存在抑制了
的存在抑制了![]() 的水解。
的水解。
6.D 酸性强弱要看电离![]() 的程度,D项中酸浓度为
的程度,D项中酸浓度为![]() 时的
时的![]() 为1,说明酸中的
为1,说明酸中的![]() 全部电离,酸为强酸。注意B、C不成立,如醋酸可溶解
全部电离,酸为强酸。注意B、C不成立,如醋酸可溶解![]() 、
、![]() 。
。
7.C ![]() ,溶液可为强酸,
,溶液可为强酸,![]() 或强碱
或强碱![]() ,而C项在碱性环境下可大量共存。
,而C项在碱性环境下可大量共存。
8.C “血液透析”即为渗析,B项为胶体的盐析,D项为胶体的电泳。
9.A HA为弱酸,在BOH溶液里![]() ,
,![]() ,
,![]() ,BOH为强碱。酸碱恰好反应,生成的BA发生水解。
,BOH为强碱。酸碱恰好反应,生成的BA发生水解。
10.B 达到滴定终点恰好生成HCOONa,溶液因水解显碱性。
11.C A项醋酸为弱酸应写化学式;B项铁锈为![]() ;D项稀硝酸生成
;D项稀硝酸生成![]() 。
。
12.B 由于电离平衡![]() ,因稀释而向正反应方向移动,因而在同等稀释的前提下,
,因稀释而向正反应方向移动,因而在同等稀释的前提下,![]() 的浓度将进一步减小,由
的浓度将进一步减小,由![]() 电离出来的
电离出来的![]() 浓度会有一定程度的增加,即在溶液中
浓度会有一定程度的增加,即在溶液中![]() 。若再逐渐稀释下去,直到氨水的碱性逐渐减弱而接近极限的状态下,氨水的浓度会一直减弱下去,但
。若再逐渐稀释下去,直到氨水的碱性逐渐减弱而接近极限的状态下,氨水的浓度会一直减弱下去,但![]() 离子的浓度会逐渐接近并保持一个常量:
离子的浓度会逐渐接近并保持一个常量:![]() 。因此,将
。因此,将![]() 水稀释,分数
水稀释,分数![]() 永远是分母大于分子,即其值随着水量的增加而减小。
永远是分母大于分子,即其值随着水量的增加而减小。
13.B 由于![]() +
+ ![]()
![]() 过量,故
过量,故![]() ;
;
14.A 加入![]() 后,
后,![]() ,而
,而![]() 会被氧化。
会被氧化。
15.CD 石蕊因变色不明显,不能作指示剂;注意:甲为酸式滴定管,乙为碱式滴定管。
16.(1)abc (2)c (3)9.5
17.(1)弱电解质溶液稀释10a倍,![]() 改变小于a (2)将一定浓度的酸稀释到一定量(如100倍体积)后,测定稀释前后溶液的
改变小于a (2)将一定浓度的酸稀释到一定量(如100倍体积)后,测定稀释前后溶液的![]() (3)稀释的倍数,稀释前后溶液的
(3)稀释的倍数,稀释前后溶液的![]() (4)溶液稀释100倍体积后,溶液的
(4)溶液稀释100倍体积后,溶液的![]() 的改变小于2;稀释过程中酸的电离程度增大
的改变小于2;稀释过程中酸的电离程度增大
18.C;先加稀盐酸,发生反应![]() ,故
,故![]() 浓度增大后发生
浓度增大后发生![]() 浓度减小
浓度减小
19.![]() ;1:6;
;1:6;![]() 的量偏少,产生
的量偏少,产生![]() 气体减少;
气体减少; ![]() 水解后溶液显酸性,会腐蚀金属铁
水解后溶液显酸性,会腐蚀金属铁![]()
![]()
![]() ,
,![]()
20.(1)否;若a=3,则b=6,溶液显酸性,与题意不符,故![]()
(2)否;若a=5,则![]() ,即b=10,
,即b=10,![]() ,
,![]() 不符合题意,故
不符合题意,故![]()
(3)![]() 解析:
解析: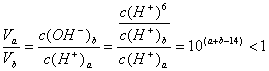 ,所以
,所以![]() ,而
,而![]()
即![]() 。又
。又![]() ,所以
,所以![]()
21.减小;因为![]() 溶液露置于空气中,与空气中
溶液露置于空气中,与空气中![]() 反应,使
反应,使![]() 减少,溶液的
减少,溶液的![]() 减小 (1)
减小 (1)![]() (2)
(2)![]()
22.(1)![]() ;
;![]() ;盐酸 (2)
;盐酸 (2)![]()
23.(1)900 (2)1000 (3)81.8
24.(1)玻璃棒;容量瓶;胶头滴管(2)24.8 (4)淀粉
(5)设![]() 混合液遇酸反应后生成
混合液遇酸反应后生成![]() 的物质的量为
的物质的量为![]()
![]()
1 3
![]() x
x ![]()
设过量的![]() 的物质的量为
的物质的量为![]() ,由
,由![]()
知:![]()
则与苯酚反应的溴的物质的量![]()
设100mL废水中苯酚的物质的量为zmol
由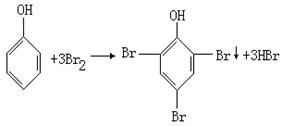
知:![]()
废水中苯酚的含量为![]()
可知,超过国家标准,不能排放。