晶体结构题型例析与训练
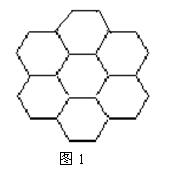 例题1: 石墨的片层结构如图1所示:试回答:
例题1: 石墨的片层结构如图1所示:试回答:
(1)片层中平均每个六元环含碳原子数为 个。
(2)在片层结构中,碳原子数、C—C键数、六元环数之比
为
【解析】在石墨的片层结构中,我们以一个六元环为研究对象,由于碳原子为三个六元环共用,即属于每个六元环的碳原子数为6×1/3=2;另外碳碳键数为二个六元环共用,即属于每个六元环的碳碳键数为6×1/2=3。
【答案】(1).2 (2).2:3:1
例题2:已知NaCl 晶体的中最小重复单元(晶胞)如图2所示, 氯化钠的摩尔质量为M g/mol, 氯化钠的密度为 a g/cm3 ,阿佛加德罗常数为NA, 回答下列问题:
(1)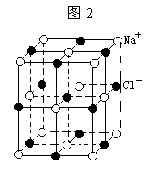 每个Na+ 周围距离相等且最近的Cl-所围成的空间构型为 _____
每个Na+ 周围距离相等且最近的Cl-所围成的空间构型为 _____
(2)NaCl 晶体的晶胞可看作由_____ 个Na+ 和____个 Cl-组成
(3)每个Na+ 周围距离相等且最近Cl- Na+分别有 ______个
(4)求氯化钠的晶体中最邻近的钠离子和氯离子中心间的距离为 ____
(要有解题的过程)
【解析】在氯化钠的晶体结构中,在体心的微粒被此晶胞所独有
(即1/1,见图3);在面心的微粒被2个晶胞所共有(即1/2,见图4);在棱上的微粒被4个晶胞所共有(即1/4,见图5);在顶点上的微粒被8个晶胞所共有(即1/8,见图6)。
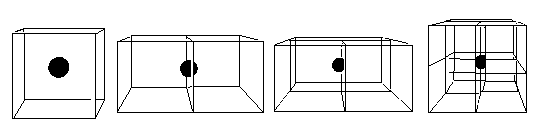
图3(体心-1/1) 图4(面心-1/2) 图5(棱上-1/4) 图6(顶点---1/8)
由NaCl 晶体的晶胞可知,1个晶体的晶胞由8个小立方体构成,每个小立方体的8 个顶点分别由4个Na+ 和4个 Cl- 占据,每个Na+ Cl- 都只有1/8占据在小立方体中,因而每个小立方体含有Na+ Cl- 都为4 ×1/8=1/2,即含有NaCl 1/2个。设每个小立方体的边长为bcm 则有b3 ×a = M/2NA 即可得b的值。
【答案】(1)八面体(双四棱锥) (2)Na+ =8×1/8+6×1/2=4Cl-=12×1/4+1=4个
 (3)6 个
12个
(4)
(3)6 个
12个
(4) ![]() cm
cm
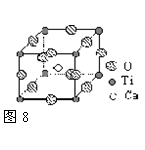
例3: 图8是超导化合物----钙钛矿晶体的晶胞结构。请回答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其
他钛离子共有 个。
【解析】这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1.钛位于立方体的顶点上,与一个钛离子距离最近的钛离子是与它共棱的,与它共棱的离子都是二个,所以,共6个。
【答案】(1)该化合物的化学式为CaTiO3 (2) 6个
【小结】:已知晶胞的结构而求晶体的化学式是最常见的题型。
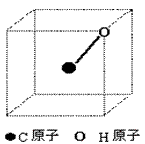 例题4:CH4分子在空间呈四面体形状,1个C原子与4个H原子各共用一对电子对形成4条共价键,如图8所示为一个正方体,已画出1个C原子(在正方体中心)、1个H原子(在正方体顶点)和1条共价键(实线表示)
例题4:CH4分子在空间呈四面体形状,1个C原子与4个H原子各共用一对电子对形成4条共价键,如图8所示为一个正方体,已画出1个C原子(在正方体中心)、1个H原子(在正方体顶点)和1条共价键(实线表示)
(1)请画出另3个H原子的合适位置和3条共价键;
(2)请计算分子中碳氢键的键角
【解析】由于碳原子在正方体中心,一个氢原子在顶点,因为碳氢键是等长的,那么另三个氢原子也应在正方体的顶点上,正方体余下的七个顶点可分成三类,三个为棱的对侧,三个为面对角线的对侧,一个为体对角线的对侧。显然三个在面对角线对侧上的顶点为另三个氢原子的位置。
在化学中不少分子是正四面体型的如CH4、CCl4、NH4+、 SO42-它们的键角都是109º28’,那么这个值是否能计算出来呢?
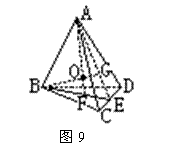
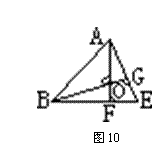
如果从数学的角度来看,这是一个并不太难的立体几何题,首先我们把它抽象成一个立体几何图形(如图9所示),取CD中点E,截取面ABE(如图10所示),过A、B做AF⊥BE,BG⊥AE,AF交BG于O,那么
∠AOB就是所求的键角。我们只要找出AO(=BO)与AB的关系,再用余弦定理,就能圆满地解决了。当然找出AO和AB的关系还 是有一定难度的。将正四面体ABCD放入正方体中考虑,设正方体的边长为1,则AB为面对角线长,即![]() ,AO为体对角线长的一半,即
,AO为体对角线长的一半,即![]() /2,由余弦定理得
/2,由余弦定理得
 cosα=(AO2+BO2-AB2)/2AO·BO=-1/3
cosα=(AO2+BO2-AB2)/2AO·BO=-1/3
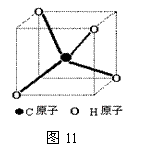
【答案】(1)如图11。(2)甲烷的键角应为 π-arccos1/3
【小结】在正四面体中八个顶点中不相邻的四个顶点(不共棱)可构成一个正四面体,正四面体的棱长即为正方体的棱长的![]() 倍,它们的中心是互相重合的。
倍,它们的中心是互相重合的。
【高考题训练】
1.在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有___________(填数字)个碳原子,每个碳原子上的任意两个C—C键的夹角都是__________(填角度)。(92年 32题2分)
【答案】6 (1分) 109°28′(或109。5°)(只写出109°,可以给分) (1分)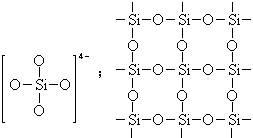
2.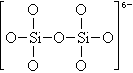 下图是石英晶体平面示意图(如图12),它实际上是立体的网状结构,其中硅、氧原子数之比为____。原硅酸根离子SiO44-的结构可表示为二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示 为__________。(96年 29题4分)
下图是石英晶体平面示意图(如图12),它实际上是立体的网状结构,其中硅、氧原子数之比为____。原硅酸根离子SiO44-的结构可表示为二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示 为__________。(96年 29题4分)
【答案】1:2(1分) (3分) 图12
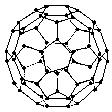 3. 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图13),该结构的建立基于以下考虑:
3. 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图13),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
图
13
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是:______.
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)_________________________,并简述其理由: ___________________.
(3)通过计算,确定C60分子所含单键数.C60分子所含单键数为_______________.
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
C70分子中所含五边形数为____________,六边形数为________.(97年 36题 12分)
【答案(1)金刚石 金刚石属原子晶体,而固体C60不是,故金刚石熔点较高. (1分)
(2)可能因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60(1分)
![]()
也可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90
C60分子中单键为:90-30=60 (1分) (答“2×30(双键数)=60”即给2分)
(4)设C70分子中五边形数为x,六边形数为y.依题意可得方程组:

解得:五边形数x=12,六边形数y=25 (各1分)