专题练习(晶体类型及其性质)
1.下列叙述中,正确的是( )
A.只含非金属元素的离子不一定都是阴离子 B.分子晶体中也可能含有离子键
C.含有离子键的晶体一定是离子晶体 D.含金属元素的离子一定都是阳离子
2.下列物质熔点的比较正确的是( )
A.CsCl>NaCl B.金刚石>晶体硅 C.PH3>NH3 D.Na>K
3.在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰,下列推断正确的是( )
A.原子晶体干冰易气化,可用作致冷材料
B.原子晶体干冰有很高的熔、沸点,有很大的硬度
C.每摩原子晶体干冰中含C—O键数为2NA
D.原子晶体干冰硬度大,可用作耐磨材料
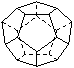
4.据某科学杂志报道,国外有一研究所发现了一种新的球形分子,它的分子式为C60Si60,它的分子结构好似中国传统工艺品“镂雕”。经测定其中包含有C60和Si60结构。下列说法不正确的是( )
A.该物质有很高的熔点、很大的硬度 B.该物质形成的晶体是分子晶体
C.该物质分子中Si60被包裹在C60里 D.该物质相对分子质量为2400
 |
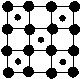
5.2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如右图(小球表示Co原子、大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )
A B C D
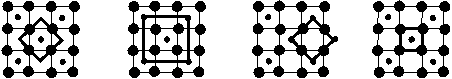
 6.德国和美国的科学家在2000年制造出了由20个碳原子组成的空心笼状分子(如图所示),该分子是富勒烯家族中最小的,只由正五边形组成。下列说法中正确的是( )
6.德国和美国的科学家在2000年制造出了由20个碳原子组成的空心笼状分子(如图所示),该分子是富勒烯家族中最小的,只由正五边形组成。下列说法中正确的是( )
A.该分子与C60互为同分异构体 B.该分子中有12个正五边形
C.该分子中所含双键数为20 D.该物质的晶体是原子晶体
7.回答下列有关晶体结构的问题。
⑴在氯化钠晶体中,与一个氯离子距离最近且相等的钠离子数是___________;
⑵在氯化铯晶体中,与一个氯离子距离最近且相等的铯离子数是___________;
⑶在干冰晶体中,与一个CO2分子距离最近且相等的CO2分子数是____________;
⑷在金刚石晶体中,如果有1 mol 碳原子,则C—C键的数目为____________NA;
⑸二氧化硅晶体中,硅原子与氧原子形成的最小的环是____________元环。
8.离子晶体中的阴、阳离子是有规律排布的,X射线测得氯化钠晶体中靠得最近的Na+与Cl-离子间的距离为d cm,借助这一数据,某化学实验小组设计了一个测定阿伏加德罗常数的实验方案,该方案的关键是测定NaCl的密度。
⑴实验室中现有天平,用它可称量NaCl样品的 。
⑵将称取的细粉状的NaCl样品加入 25 mL容量瓶中,然后用酸式滴定管向容量瓶中加入一种液体,至凹液面与容量瓶刻度线相切,读得加入液体体积为V mL,则NaCl样品的体积为 。
问题:①所取NaCl样品必须是细粉状,为什么不能是块状?
__________________________________________________________。
②向容量瓶中加入的液体可以是 (选填“水”或“四氯化碳”),简述选这种液体和不选另一种液体的理由是 。
⑶经测定NaCl晶体的密度为ρ(g·cm-3),摩尔质量为M(g·mol-1),试写出计算阿伏加德罗常数NA的公式(式中物理量都用字母表示)。
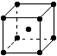 9.在晶体中具有代表性的最小重复单元,称为晶胞。右图是金属钨晶体中的一个晶胞的结构模型图(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm—3,钨的相对原子质量为183.9。假定金属钨为等直径的刚性球,请回答以下各题:
9.在晶体中具有代表性的最小重复单元,称为晶胞。右图是金属钨晶体中的一个晶胞的结构模型图(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm—3,钨的相对原子质量为183.9。假定金属钨为等直径的刚性球,请回答以下各题:
⑴每一个晶胞中分摊到 个钨原子。
⑵计算晶胞的边长a。
⑶计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
⑷计算金属钨原子采取的体心立方结构的空间利用率。
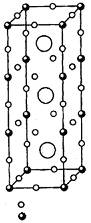 10.晶体是质点(分子、原子或离子)在空间有规则地排列而成的、具有整齐的外形、以多面体出现的固体物质。在空间里无限地周期性的重复能成为晶体具有代表性的最小单位,称为单元晶胞(平行六面体)。
10.晶体是质点(分子、原子或离子)在空间有规则地排列而成的、具有整齐的外形、以多面体出现的固体物质。在空间里无限地周期性的重复能成为晶体具有代表性的最小单位,称为单元晶胞(平行六面体)。
⑴1987年科学家发现了高温超导体钇钡铜氧材料,其晶胞如右图所示。如该晶胞中不存在氧空位,则该材料的理想化学式为______
_______________________。
⑵事实上该材料中存在着氧空位,实际测量该材料的密度ρ=6.377g·cm-3,列式计算出该材料的化学式(已知晶胞参数为a=0.3823 nm,b=0.3885 nm,c=1.168 nm)。
⑶由⑵的计算可知,该晶胞中氧空位的百分数为_________;该材料中钇(+3价)、钡、氧的化合价保持不变,有的材料中氧空位的百分数会增加,这是因为_______________
________;有的材料中氧空位的百分数会减少,这是因为______________________。
参考答案
1.AC 2.BD 3.BD 4.AC 5.D 6.B
7.⑴6 ⑵8 ⑶12 ⑷2 ⑸12
8.⑴质量
⑵(25-V)mL ①块状固体中可能有空隙,使测量的体积不准。②四氯化碳。NaCl可溶于水,总体积不是两者体积之和;NaCl难溶于四氯化碳,可认为总体积是两者体积之和。
⑶ρg·cm-3×2d3cm3×NA=M g·mol-1
9.⑴2 ⑵0.3163 nm ⑶0.137 nm ⑷68.02%[说明] ⑴晶胞中每个角的钨原子为8个晶胞所共有,中心钨原子完全为该晶胞所有,故晶胞中钨原子数为1+8×1/8=2。⑵每个晶胞中含2个钨原子,则:NA·a3=2 mol×183.9 g·mol—1/(19.30 g·cm—3)⑶晶胞体对角线的长度为钨原子半径的4倍,则:4r=√3a ⑷每个晶胞中含2个钨原子,则体心立方结构的空间利用率为:2×(4/3)πr3/ a3×100%。
10.⑴YBa2Cu3O9
⑵ρ=![]() =6.377g·cm-3
=6.377g·cm-3
解得x=7 化学式为YBa2Cu3O7
⑶22.22% 低价铜的含量增加 高价铜的含量增加