普通高等学校招生全国统一化学考试4
理科综合能力测试(全国卷Ⅰ)
(化学部分)
6.能与人体血液中血红蛋白结合的一种有毒气体是
A.氯气 B.氮气 C.一氧化碳 D.甲烷
7.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
8.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
9.下列说法不正确的是
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.32 g 氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2L
10.常温下,以下4种溶液pH最小的是
A.0.01 mol·L-1醋酸溶液
B.0.02 mol·L-1醋酸与0.02 mol·L-1NaOH溶液等体积混合液
C.0.03 mol·L-1醋酸与0.01 mol·L-1NaOH溶液等体积混合液
D.0.02 mol·L-1醋酸与0.03 mol·L-1NaOH溶液等体积混合液
11.下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+===Ca2++2H2O
B.钠与水的反应Na+H2O===Na++2OH-+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+===Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
12.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
A.H2 B.CO C.C6H12O6 D.C12H22O11
13.已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2(g) △H=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2(g) △H=-393.41 kJ·mol-1
据此判断,下列说法正确的是
A.由石墨制备金刚石中吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石中吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石中放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石中放热反应;等质量时,石墨的能量比金刚石的高
26.某有机物A的结构简式如下:
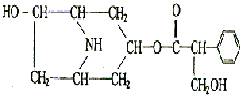
(1)A的分子式是 。
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是B:
,C: 。该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是 。
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
①浓H2SO4和浓HNO3的混合液 ②CH3CCH2OH(酸催化) ③CH3CH2CH2CH3
④Na ⑤CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的所有同分异构休的结构简式
① 化合物是1,3,5—三取代苯
②
苯环上的三个取代基分别为甲基、羟基和含有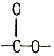 结构的简图
结构的简图
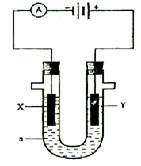 27.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
27.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都有是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则,
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
28.有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2、和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显现象。试回答下面问题。
| A | B | C | D | E | F | G | |
| A | — | — | — | — | — | — | ↓ |
| B | — | — | — | — | ↓ | ↓ | ↓ |
| C | — | — | — | — | ↓ | ↓ | |
| D | — | — | — | ↓ | ↓ | ↓ | |
| E | — | ↓ | — | ↓ | — | ↓ | — |
| F | — | ↓ | ↓ | ↓ | ↓ | — | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | — | ↓ | — |
(1)A的化学式是 ,G的化学式是 。判断理由是 。
(2)写出其余几种物质的化学式,B: ,C: ,D: ,E: ,F: 。
29.恒温下,将a mol N2与b mol H2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n( 始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。