普通高等学校招生全国统一化学考试6
理科综合能力测试(全国卷Ⅱ)
(化学部分)
6.在pH=1含Ba2+离子的溶液中,还能大量存在的离子是
A.AlO2- B.ClO- C.Cl- D.SO42-
7.物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
8.已知
(1)H2(g)+1/2O2(g)===H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
9.将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
10.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
11.若1 mol某气态烃CxHy,完全燃烧,需用3 mol O2,则
A.x=2,y=3 B.x=3,y=4 C.x=3,y=6 D.x=3,y=8
12.下列分子中,所有原子不可能共处在同一平面上的是
A.C2H2 B.CS2 C.NH3 D.C6H6
13.常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO
B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3
D.Na2CO3 NaHCO3 K2CO3
26.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,产物中的单质B是 。
(2)②中所发生的各反应的化学方程式是 。
(3)③中所发生的各反应的离子方程式是 。
(4)若溶液中D的体积仍视为0.15 L,则溶液中c(Mg2+)为 ,c(Fe2+)为 。
27.科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学或医学奖。
请回答下列问题:
(1)已知M的分子量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.5%。则M的分子式是 。D是双原子分子,分子量为30,则D的分子式为 。
(2)油酯A经下列途径可得到M。
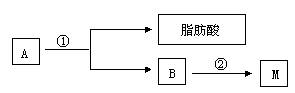
图中②的提示:
C2H5OH+HO—NO2![]() C2H5O—NO3+H2O
C2H5O—NO3+H2O
硝酸 硝酸乙酯
反应①的化学方程式是 。
反应②的化学方程式是 。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式 。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗 g金属钠。
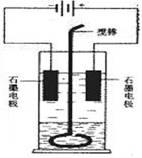 28.在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
28.在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为 。
(2)阴极上的电极反应式为 。
(3)原上层液体是 。
(4)原下层液体是 。
(5)搅拌后两层液体颜色发生变化的原因是 。
(6)要检验上层液体中含有的金属离子 ,现象是 。
29.抗击“非典”期间,过氧乙酸(![]() )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4_+ H2O2+ H+=== Mn2++ O2+ H2O
②H2O2+2I-+2H+===I2+2H2O
③![]() +2I-+2H+===CH3COOH+I2+H2O
+2I-+2H+===CH3COOH+I2+H2O
④I2+2S2O32-====S4O62-+2I-
请回答以下问题:
(1)配平反应①的离子方程式(配平系数填入答题卡相应的方框内):
MnO4_+ H2O2+ H+=== Mn2++ O2+ H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是 。
(3)取b0 mL 待测液,用硫酸使溶液酸化,再用浓度为a1 mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL 待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生I2(反应②和③)。再用浓度为a2 mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、a0、b1、b2的代数式表示)。
C0= 。
(4)为计算待测液中过氧乙酸的浓度c0 ,加入的KI的质量已过量但没有准确称量,是否影响测定结果 (填“是”与“否”)。