高三年级专题训练(溶解度)
班级________姓名________得分_________
[1].20℃时澄清的饱和石灰水,发生如下不同变化,其中不会出现白色浑浊的是
A.降低温度 B.升高温度 C.温度不变,蒸发溶剂 D.通入CO2
[2].要使wg 10%的NaCl溶液的溶质的质量分数增至20%,可采用的方法是
A.再加入![]() g固体NaCl
B.蒸发浓缩成
g固体NaCl
B.蒸发浓缩成![]() g NaCl溶液
g NaCl溶液
C.蒸发掉一半溶剂 D.再加入2wg 25%的NaCl溶液
[3].分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。下列关于甲、乙的溶解度的叙述中肯定正确的是
A.20℃时,乙的溶解度比甲的大 B.80℃时,甲的溶解度比乙的大
C.温度对乙的溶解度影响较大 D.温度对甲的溶解度影响较大
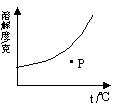 [4].右图是物质M的溶解度曲线图,则P点表示
[4].右图是物质M的溶解度曲线图,则P点表示
A.饱和溶液 B.不饱和溶液
C.M未完全溶解 D.无法配制
[5].将40℃的饱和石灰水冷却至10℃或温度仍为40℃而加入少量CaO,这两种情况下都不改变的是
A.Ca(OH)2的溶解度 B.溶液的质量分数(百分比浓度)
C.溶液的质量 D.溶液中Ca2+的数目
[6].有一杯t℃时的硝酸铵溶液,在该溶液中加入x g硝酸铵晶体,充分搅拌后有y g未溶;若将原溶液加热蒸发掉2g水再冷却至原温度,溶液恰好达到饱和,则t℃时硝酸铵的溶解度
A.![]() g B.
g B.![]() g C.
g C.![]() g
D.
g
D.![]() g
g
[7].在烧杯中盛有10%的CaCl2溶液,然后向烧杯中逐滴加入10%的Na2CO3溶液至不再生成沉淀为止,过滤得到CaCO3沉淀10g,再将滤液蒸发掉90g水后,所剩溶液的质量分数是多少?
A.11.7% B.10% C.9.2% D.5.85%
[8].在25℃时,将某浓度的芒硝溶液分为等质量的两份溶液,一份加热蒸发掉20g水后降至25℃成为饱和溶液,另一份加入10g芒硝晶体后也成为饱和溶液。则25℃时芒硝的溶解度是
A.20g B.17.23g C.30g D.22.05g
[9].某温度下,在100g水中加入mg CuSO4或加入ng CuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合
A.m=![]() B.m=
B.m=![]() C.m=
C.m=![]() D.m=
D.m=![]()
[10].在t℃时,取可溶物A其浓度为a%的溶液100g,蒸发掉p g水,冷却到t℃,析出A的不含结晶水的晶体g g,则在t℃时,A的溶解度为
A.![]() g B.
g B.![]() g C.
g C.![]() g
D.
g
D.![]() g
g
[11].在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为
A.23(W-B)/123g B.23(W-B)/77g
C.23(W-B)/100g D.(W-77B/23)/g
[12].某温度下,氯化镁饱和溶液浓度为40%,在足量的此溶液中加入4.6g无水氯化镁,最终析出结晶水合物40.6g,则该结晶水合物的化学式是
A.MgCl2·7H2O B.MgCl2·2H2O C.MgCl2·6H2O D.MgCl2·5H2O
[13].某温度下,向一定质量的饱和石灰水中加入少量生石灰,并恢复到原温度,则
A.溶质的溶解度不变 B.溶液中溶质的质量增加
C.溶质的质量分数减少 D.溶质的质量分数增大
[14].Ca(OH)2在80℃时的溶解度为x g,20℃时溶解度为y g,取80℃时Ca(OH)2的饱和溶液a g蒸发掉w g水后,再恢复至20℃,滤去折出固体,滤液中Ca(OH)2的质量分数为z%,则x、y、z的关系正确的是
A.x>y>z B.y<z<x C.x<y D.y>z
[15].有m1g KCl饱和溶液,其溶质的质量分数为c1%。采取某种措施后析出m3g KCl晶体,母液质量为m2g,其溶质的质量分数为c2%。则下列关系正确的是
A.C1一定大于C2 B.m1-m3=m2
C.m1-m3=100m3 D.原条件下KCl的溶解度小于c1g
[16].某学生在10℃时取100g水配制成氯化钾的饱和溶液,又取50g水加入35.4g硝酸钠配成溶液,然后将两种溶液混合,发现有晶体析出。已知10℃时,氯化钾、硝酸钠、氯化钠、硝酸钾的溶解度依次为31g、80g、35.8g、20.9g。通过计算可推断出析出的晶体是
A.氯化钾 B.硝酸钠 C.氯化钠 D.硝酸钾
[17].浓度不等的两种硫酸溶液等质量混和时,其质量百分比浓度为a%,而等体积混和时为b%;浓度不等的两种乙醇溶液等质量混和后,其质量百分比浓度也为a%,而等体积混和时为c%,则a、b、c间的关系时是
A.a>b>c B.b>a>c C.c>a>b D.不可比较
[18].已知:t℃时,某物质的不饱和溶液a g中含溶质m g,若蒸发b g水并恢复到t℃时,析出溶质m1g。若原溶液蒸发c g水并恢复到t℃时,则析出溶质m2g。用S表示该物质在t℃的溶解度,下列表达式中正确的是
A.S=![]() B.S=
B.S=![]() C.S=
C.S=![]() D.S=
D.S=![]()
[19].有一种由CaCl2 和NaCl组成的混和物,取34.8g溶于50g水使其充分溶解后,加入m g某浓度的Na2CO3溶液恰好完全反应,生成20g沉淀。经过滤,所得滤液在t℃时刚好为饱和溶液(已知t℃时NaCl的溶解度为36g)。试求:
(1)m值
(2)所加Na2CO3溶液的质量分数
[20].将100g 15%的NaCl溶液稀释成10%的NaCl溶液,取稀释后的溶液11.7g与17g AgNO3溶液混合恰好完全反应。求:
(1)稀释NaCl溶液时所加水的质量
(2)AgNO3溶液的溶质质量分数
[21].将200g浓度为3.65%的稀盐酸加入到80g浓度为10%的NaOH溶液里恰好完全反应,(已知20℃时NaCl的溶解度为36g)试求:
(1)反应后溶液中水的质量
(2)若将反应后所得溶液制成20℃时的饱和溶液,需蒸发掉多少克水?
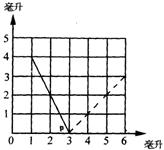 [22].已知同温同压下,相同体积的不同气体中含有相同数目的分子。右图是一定体积的氢气和不同体积的氧气合成水(液态)的实验数据的关系图(横坐标表示反应前氧气的体积,纵坐标表示反应后剩余气体的体积,气体体积均在同温同压下测定),试回答:
[22].已知同温同压下,相同体积的不同气体中含有相同数目的分子。右图是一定体积的氢气和不同体积的氧气合成水(液态)的实验数据的关系图(横坐标表示反应前氧气的体积,纵坐标表示反应后剩余气体的体积,气体体积均在同温同压下测定),试回答:
(1)实线部分表示剩余的气体是 ;
(2)虚线部分表示剩余的气体是 ;
(3)实线与虚线的交点P表示的意义是 ;
(4)反应前原有氢气 mL。
[23].已知在体积不变的密闭容器中,气体的压强与气体的分子数成正比。将一小块焦炭和mg氧气同时放入一装有压力表的容器中,压力表所示为p0,当充分反应后,恢复到原来温度,压力为p1。
(1)如果p0<p1,则焦炭质量w应满足的关系式是 。
(2)如果p0=p1,则w应满足的关系式是 。
(3)如果p1是p0的n倍,则w是 g,n的取值范围是 。
[1] A
[2] B、D
[3] D
[4] B
[5] B
[6] C
[7] B
[8] B
[9] B
[10] A
[11] A
[12] C
[13] A
[14] C、D
[15] B、C
[16] D
[17] B
[18] C
[19] (1)71.2 (2)29.8%
[20] (1)50克 (2)20%
[21] (1)268.3 (2)235.8克
[22] (1)H2 (2)O2 (3)H2和O2恰好完全反应 (4)6
[23] (1)w>3m/8 (2)0<w≤3m/8 (3)3mn/8 1≤n≤2