高三年模拟试卷(5月)化学卷
化 学 试 题
第Ⅰ卷(选择题,共45分)
(满分:100分;时间:120分钟)
可能用到的相对原子质量:H:1 N:14 O:16 Na:23 Mg:24 Al:27 Zn:65
一、选择题(每个小题只有一个选项符合题意,每小题2分,本题共18分)
1.我国禁止使用的商品是 ( )
A.无铅汽油 B.无磷洗衣粉
C.无氟冰箱 D.无碘食盐
2.为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找能源,以下做法不能提高燃料效率的是 ( )
A.煤的汽化与液化 B.液体燃料呈雾状喷出
C.通入大大过量的空气 D.将煤粉粉碎
3.一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是( )
A.B4C是一种分子晶体
B.B4C是一种离子晶体
C.B4C是一种原子晶体
D.B4C分子是由4个硼原子和1个碳原子构成的
4.下列固体物质中阴阳离子的个数比不是1:1的是 ( )
A.NaHCO3 B.Na2O2 C.NaOH D.CaC2
5.某溶液中有NH4+、Fe2+、Ag+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中不会大量减少的离子是 ( )
A.NH4+ B.Fe2+ C.Ag+ D.Al3+
6.下列离子方程式书写正确的是 ( )
A.碳酸钡中加入稀硫酸:BaCO3+2H+ Ba2++CO2↑+H2O
B.硫酸铝溶液中滴加过量氨水:Al3++3NH3·H2O Al(OH)3↓+3NH4+
C.偏铝酸钠溶液中通入过量CO2:2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-
D.次氯酸钙溶液中通入过量CO2;Ca2++2ClO-+CO2+2H2O CaCO3↓+2HClO
7.下列试剂的保存方法不正确的是 ( )
A.少量白磷保存在水中 B.少量金属钠保存在煤油中
C.固体烧碱保存在带橡皮塞的细口瓶中 D.水玻璃保存在带橡皮塞的细口瓶中
8.下列各组离子在溶液中可以大量共存,加入过量盐酸后产生沉淀的是 ( )
A.K+、Ba2+、Cl-、SO42- B.K+、AlO2-、NO3-、OH-
C.H+、Fe2+、Cl-、NO3- D.Na+、Cl-、NO-3、SiO32-
9.下列叙述中的非金属元素,其氢化物最稳定的是 ( )
A.构成矿物和岩石的主要元素 B.空气中含量最多的元素
C.单质在常温下是液态的元素 D.地壳中含量最多的元素
二、选择题:(每个小题只有一个选项符合题意,每小题3分本题共27分。)
10.根据化学方程式:S(s)+O2(g) SO2(g);△H= -297.23kJ·mol-1,分析下列说法正确的是( )
A.S(g)+O2(g) SO2(g);△H=-297.23kJ·mol-1
B.S(g)+O2(g) SO2(g);
△H<-297.23kJ·mol-1
C.SO2(g) S(g)+O2(g);
△H<+297.23kJ·mol-1
D.SO2(g) S(s)+O2(g);
△H>+297.23kJ·mol-1
11.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入另一种气体X仍未沉淀,则X可能是 ( )
A.CO2 B.NH3 C.Cl2 D.NO2
12.用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解氯化铜溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1
D.电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2
13.将一定量的Mg、Zn、Al混合物与足量的稀硫酸反应,生成H22.8L(标准准状况),原混合物的质量可能是 ( )
A.2 g B.5g C.10g D.12g
14.代表阿伏加德罗常数,下列说法正确的是 ( )
A.7.8gNa2O2与足量CO2反应,转移电子的个数为0.2NA
B.16gO2与16gO3所含有的氧原子数是NA
C.常温常压下,1moL水中含有NA个H+和NA个OH-
D.17克氨中共价键的数目为NA
![]()
![]() 15.X1和X2分别为两个恒容容器中平衡体系A(g)
2B(g)和2A(g) B(g)的转化率,在温度不变的情况下均增加A的物质的量,下列判断正确的是 ( )
15.X1和X2分别为两个恒容容器中平衡体系A(g)
2B(g)和2A(g) B(g)的转化率,在温度不变的情况下均增加A的物质的量,下列判断正确的是 ( )
A.X1降低、X2增大 B.X1、X2均降低
C.X1增大、X2降低 D.X1增大,X2增大
16.HClO3是一种具有强氧化性的强酸,预计Cu和HClO3溶液反应的生成物不可能是( )
A.H2 B.Cl2 C.Cu(ClO3)2 D.CuCl2
17.2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 N2↑+4H2O↑+Cl2+2O2↑;△H<0。下列有关叙述不正确的是 ( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.上述反应瞬间能产生大量高温气体推动飞船飞行
C.从能量变化上说,主要是化学能转变为热能和动能
D.在反应中NH4ClO4仅起到氧化剂作用
18.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量小
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的 c(H+)小
第Ⅱ卷(非选择题,共55分)
三、实验题(15分)
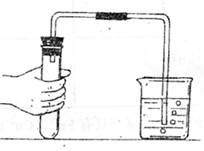
|
(1)此法的原理是
。
(2)某同学操作时,只做了①没有做②,他即认为装置的气密性良好。你认为他的结论是否正确?
(答“是”或“否”)。理由是
。
20.(10分)某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,设计如下方案:
| 操 作 | 结 论 | |
| 甲 | 火柴梗 | 变黑者为浓硫酸 |
| 乙 | 加入金属铝片 | 产生刺激性气味者为浓硫酸 |
| 丙 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 丁 | 用玻璃棒蘸浓氨水靠近盛酸的瓶口 | 冒白烟者为浓梳酸 |
| 戊 | 加到CuSO4·5H2O晶体中 | 变白者为浓硫酸 |
(1)其中可行的是 。
(2)其中一个稍作改进就能成为可行的是 ,改进方法是 。
(3)完全错误的是 ,因为 。
(4)请给出另外两种鉴别方法
| 操 作 | 根据现象做出结论 | |
| A. | ||
| B. |
四、填空题(15分)
21.(8分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
若上述关系中④是正确的,则溶液中溶质的化学式是 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合关盐酸中c(H+)和氨水中c(OH-)的关系c(H+) c(OH-)。
22.(7分)由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,于人体有害。世界环保联盟将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2),ClO2极易爆炸,生产和使用时就尽量用稀有气体稀释。
(1)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有氯气生成,且Cl2的体积为ClO2的一半,表示这一反应的化学方程式是: 。
该反应生成1mol的ClO2,电子转移 个。
(2)我国广泛用经干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应化学方程式是: 和欧洲的方法相比,我国这一方法的主要优点是: 。
五、推断题(13分)
23.(6分)已知:①短周期元素A、B、C、D的原子序数依次增大。
②A、B、D的单质都能在C的单质中燃烧,分别生成X、Y、Z。
③X分别Y、Z反应生成化合物E、F。
④单质D也能在化合物Y中燃烧生成B的单质和化合物Z。
⑤单质D还能与热的化合物X反应生成A的单质和化合物F。请回答下列问题:
(1)写出A的元素符号: 。
(2)写出D的原子结构示意图: 。
(3)写出④中反应的化学方程式:
(4)写出⑤中反应的化学方程式:
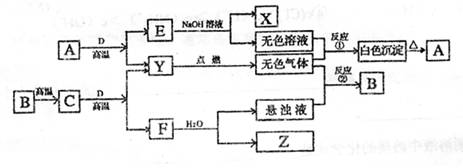
24.(7分)A、B广泛存在于自然界中,是构成岩石的主要成分。X、Y、Z都是无色可燃性气体。它们在一定条件下能实现下图所示变化:
|
(1)如果Z是能使溴水褪色的有机化合物,则X为 ,Y为 ,Z (填写化学式)。
(2)写出反应①和②的离子方程式。
反应:①
反应:②
六、计算题(12分)
25.1molCH4气体完全燃烧放出的热量为802kJ,但当不完全燃烧生成CO气体和液态H2O时,放出的热量为519kJ,如果1molCH4与ngO2燃烧生成CO、CO2气体和液态H2O,放出731.25kJ热量。
(1)写出CH4气体不完全燃烧的热化学方程式
(2)计算n的值
高三年模拟试卷
化学试题参考答案及评分标准
一、二题:(1~9题2分,10~18题3分,共45分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | C | B | D | B | C | D | D | B | A | C | B | B | A | A | D | C |
三、19.(1)当手握住试管后,温度升高,气体体积膨胀,导管口有气泡:当手离开后,温度降低,气体体积缩小,大气压将水压入导管,导管内形成一段水柱。(2分)
(2)否。(1分)当手握住试管时,温度升高较快,即使有少量漏气,导管口也会有气泡:当手离开后,温度降低缓慢气体体积缩小的慢,空气会从漏气处进入试管,不会形成水柱,因此只做①不能证明不漏气。(2分)
20.(10分)
.(1)甲、丙、戊 (2)乙 加热 (3)丁 硫酸是高沸点酸,没有挥发性。
(4)下列任意两种(或其它可行方案)均可
|
| 操 作 | 根据现象做出结论 |
| A. | 滴加到氯化钠固体中 | 产生白雾的是浓硫酸 |
| B. | 加入铝片 | 常温下反应的是稀硫酸,不反应的是浓硫酸 |
| 加入品红溶液 | 褪色的浓硫酸 | |
| 加入木炭,加热 | 产生刺激性气味气体的是浓硫酸 | |
| 称量相同体积的酸 | 质量大的是浓硫酸 | |
| 在相同条件下加热 | 先沸腾的是稀硫酸 |
四、21.(1)氯化铵(1分)①(1分);(2)NH3·H2O、NH4Cl(2分);HCl、NH4Cl(2分)(3)>(1分)
22.(1)2NaClO3+4HCl(浓)
2ClO2↑+Cl2↑+2NaCl+2H2O(2分)。6.02×1023(1分)
(2)NaClO2+Cl2+O2 2ClO2↑+NaCl(2分);不用分离ClO2和Cl2(2分)
|
五、23.(1)H(1分)(2)
点燃
(1分)(3)2Mg+CO2 2MgO+C(2分)
(4)Mg+2H2O H2↑+Mg(OH)2(2分)
24.(1)H2、CO、C2H2(各1分)
(2)SiO32-+CO2+H2O H2SiO3+CO32-(2分)
Ca(OH)2+CO2
CaCO3↓+H2O(2分)
△
六、25.(1)2CH4(气)+3O2(气)=2CO(气)+4H2O(液);△H=-1038kJ/mol
或CH4(气)+3/2O2(气)=CO(气)+2H2O(液);△H=-519kJ/mol…①
(2)1molCH4不完全燃烧放出热量519kJ,消耗氧气的质量为:48g
CH4(气)+2O2(气)=CO2(气)+2H2O(液);△H=-802kJ/mol…②
②-①得:CO(气)+1/2O2(气)=CO2(气);△H=-283kJ/mol
部分CO燃烧消耗氧气的质量为:![]()
所以n=48+12=60g