高三月考化学卷
命题人:陈国富 审核人: 靳忠平
第I卷(选择题,共72分)
可能用到的原子量:H 1、Cu 64、 Cl 35.5 、Ag 108、N 14、O 16、Na 23、C 12、Ba 137、I 127、S 32 Mg 24 Fe 56 Al 27
一、选择题(每小题只有一个选项符合题意;8 X 4分)
1、石墨炸弹爆炸时能在方圆几百米范围内撤下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨( )
A.有放射性 B.易燃、易爆 C.能导电 D.有剧毒
2、为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包藏有碳氢化合物(当然这仅仅是探索的第一步)。科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。这个实验不能用普通盐酸,其理由是( )
A.普通盐酸的酸性太强 B.普通盐酸具有挥发性
C.普通盐酸和月球岩石中的碳化物无法反应
D.无法区别岩石中原来含有的是碳化物,还是碳氢化合物
3、可逆反应N2+3H2![]() 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
4、长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈地动摇了。他们在0℃以下将氟从细冰上面通过,得到了毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液。则下列说法中不正确的是( )
A、次氟酸分子中原子间以共价键相结合 B、次氟酸分解会产生氟气
C、次氟酸与热水反应可能有H2O2生成 D、次氟酸的酸性可能比次氯酸强
5、下列贮存方法不正确的是( )
A.装碘晶体的瓶子用铁盖 B.用密封的铁槽车运输浓H2SO4
C.用干燥的钢瓶贮存液氯 D.用带橡皮塞的玻璃瓶贮存NaOH溶液
6、进行消毒时,先向水中投入一定量生石灰使污染水呈碱性,再加漂白粉、次氯酸钠。漂白粉、次氯酸钠的作用是( )
A.可使污水漂白变成无色澄清 B.可将氰化钠凝固以防止扩散
C.可将氰化钠氧化成碳酸盐和氮气 D.可将氰化钠还原成炭和氨气
7、由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能说明这个结论的是( )
A.已经制得了IBr、ICl等卤素互化物 B.已经制得了I2O5等碘的氧化物
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-离子
8、下列各种镀有金属保护层的铁板,当镀层破损时,在相同的普通环境中,最耐腐蚀的是( )
A、镀锌铁板(白铁) B、镀锡铁板(马口铁)
C、镀铜铁板 D、镀银铁板
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0 分)
9、设NA代表阿佛加德罗常数,下列说法不正确的是( )
A、2.3g金属钠变成钠离子失去电子的数目为0.1NA
B.2.0gH2所含原子数目为2NA C.17gNH3所含电子数目为10NA
D.在25℃,压强为1.01×105帕时,22.4升N2所含原子数目为2NA
10、在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a、b、c、d、、e、f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的BrF3的物质的量是( )
A.0.15mol B.0.2mol
C.0.3mol D.0.4mol
11、今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果甲瓶中加入少量的NaHCO3晶体m mol,在乙瓶中加入少量的NaHSO3晶体m mol,丙瓶不变,片刻后,甲、乙、丙三瓶中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
12、下列反应的离子方程式中,书写正确的是 ( )
A.向氢氧化钠溶液中通入过量的![]()
![]() +
+![]() =
=![]()
B.向Mg![]() 溶液中加入过量的氢氧化钠溶液
溶液中加入过量的氢氧化钠溶液
![]() +2H
+2H![]() +2O
+2O![]() =
=![]() ↓+
↓+![]() +2
+2![]()
C.硝酸铝溶液中加入过量氨水
![]() +3N
+3N![]() ·
·![]() =Al(OH)
=Al(OH)![]() ↓+3N
↓+3N![]()
D.![]()
![]() 的酸性溶液中加入足量
的酸性溶液中加入足量![]()
![]() +
+![]() =
= ![]() +S↓+2
+S↓+2![]()
13、在一定浓度的![]() 溶液中通入
溶液中通入![]() 气体,未见沉淀生成,若再通入另一种气体,有沉淀生成,则该气体不可能是 ( )
气体,未见沉淀生成,若再通入另一种气体,有沉淀生成,则该气体不可能是 ( )
A.![]() B.
B.![]()
C.HCl
D.![]()
在烧杯中盛有100mL![]() 饱和溶液,并插有pH计探头。在标准状况下,向此溶液中缓缓通入
饱和溶液,并插有pH计探头。在标准状况下,向此溶液中缓缓通入![]() 气体。下图是溶液的pH值随气体体积变化的情况(忽略溶液体积的变化)。回答14、15题:
气体。下图是溶液的pH值随气体体积变化的情况(忽略溶液体积的变化)。回答14、15题:
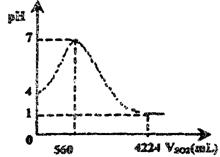
14、在标准状况下,![]() 的溶解度为(用1L水中所溶解气体的体积表示)( )
的溶解度为(用1L水中所溶解气体的体积表示)( )
A.4.224L B.42.24L C.3.664L D.36.64L
15、在![]() 饱和溶液中,
饱和溶液中,![]() 的电离平衡常数(忽略第二步电离)为 ( )
的电离平衡常数(忽略第二步电离)为 ( )
A.1×10-4 B.1×10-8 C.2×10-4 D.2×10-8
16、最近,科学家冶炼出纯度高达99.999%的铁,你估计它具有的性质是( )
A.硬度比生铁小
B.在冷、浓![]() 中可以钝化
中可以钝化
C.在潮湿的空气中放置比生铁易生锈
D.当它与生铁的粉碎粒度相同时,与4mol·![]() 盐酸反应速率比生铁大
盐酸反应速率比生铁大
17、三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮原子上的孤对电子具有结合质子的能力,则下列关于三氯化氮的叙述正确的是
A.NCl3的电子式应表示为: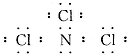
B.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
C.NCl3跟水反应的产物为HClO和NH3 D.NCl3跟水反应生成NH4Cl、O2和Cl2
18、有Mg、Al、Fe、Cu四种金属,若两两混合,取26g混合物与足量稀H2SO4反应,产生11.2L H2(标准状况)。此混合物的可能组合的方式最多有( )
A.2种 B.3种
C.4种 D.5种
第II卷(非选择题,共78分)
三、填空题:(合计58分)
19、根据下列各盐溶液的已知现象,推断出该盐的名称、化学式,并写出符合现象的离子方程式:
⑴ 往无色钠盐溶液中加盐酸,产生沉淀,继续加盐酸,沉淀消失,而往其中加氨水,沉淀又产生。_____、 ,__________________________________________。
⑵ 往某硝酸盐溶液中滴入硫化钠溶液,先看到黄色混浊物出现,滴入过量硫化钠时,又产生黑色沉淀。____、 , ___________________________________________。
20、(1)有文献报道,硫在空气中燃烧时,产物中的SO3约占5% ~ 6%(体积),而硫在纯氧中燃烧时,其产物中的SO3约占2% ~ 3%(体积),解释这一现象的正确的理由是:
。
(2)将一定量的碳酸钾溶于水配成饱和溶液,向其中滴入酚酞。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(用离子方程式和简要文字说明)
。
21、X、Y、Z三种常见的短周期元素可以形成XY2、Z2Y、XY3、Z2Y2、Y2等物质,已知Y的离子与Z的离子具有相同的电子层结构,X离子比Y离子多一个电子层。
根据以上叙述回答下列问题:
(1)X元素在周期表中的位置
(2)用电子式表示Z2Y的形成过程
(3)XY3属于 晶体,常温下为 态,XY3的水化物在低温下跟Z2Y2反应生成一种盐和一种稳定性较差的过氧化物,写出反应的化学方程式
。
(4)Z2X属于 晶体,XY3的水化物溶液跟Z2Y溶液反应的离子方程式为
,此反应生成物之一跟XY2反应的化学方程式为
。
22、有X、Y、Z3种单质,常温下X是固体,Y是液体,Z是气体。其反应
关系为
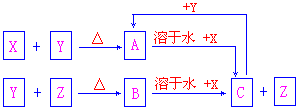
(1)据此推断X、Y、Z的化学式:
X_____________,Y______________,Z______________。
(2)X是常见的单质,它是主族元素还是副族元素____________,其理由是__
_______________________。
(3)写出C + Y → A的离子方程式
________________________________________________________。
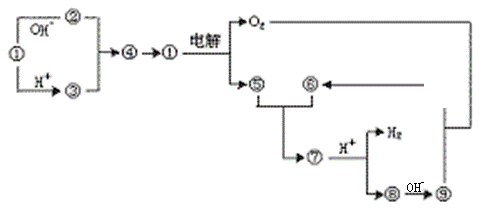
|
(1)①的化学式为___________,⑤和⑥反应的化学方程式为______________________ 。
(2)实验室由⑧制取⑨的操作为_____________________________,反应的化学方程式为__________________________,⑨转变为⑩的化学方程式为_____________________。
24、为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO )U型管下部有少量无色液体X,集气瓶中收集到无色气体Y。(如图)
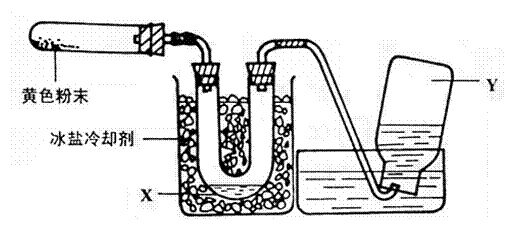 回答下面问题:
回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 ;气体Y可能是 。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意
,理由是 。
(4)用简单的实验证实(2)中的判断
①对X的判断
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
四、计算题:(20分)
25、2.24g铁与100mL稀硝酸混合后充分反应,产生气体NO,铁、硝酸均无剩余。向反应后的溶液中加入50.0mL 0.200mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
26、一定条件下,NO2和SO2很容易发生反应生成NO和SO3(气体),该反应为不可逆反应,现将NO和SO2的混合气体通入容积为100 mL的密闭容器中,充满后用带有导管的塞子密封,再向其中通入O2,使其发生反应(忽略NO2与N2O4的相互转化)
(1)若要使容器中压强不变,则通入O2的体积V(单位为mL)的大小范围应为 。
(2)若要使最后容器中只含有NO2与SO3两种气体,则需通入O2的体积是 mL。
(3)若向容器中通入40 mL O2才开始出现红棕色,且不再褪色,则原混合气体中NO的体积为 mL。
高三化学月考答题卷
一、选择题(4X18)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
二、填空题(63分)
19(10分)、(1) 、 、 ,
。
(2) 、 、 ,
。
20(6分)、(1)
。 (2) 、
。
21(12分)、(1) ;(2) ;
(3) ; ; 。
(4) ; ;
。
22(11分)、(1)X 、Y 、Z 。
(2) 、 。
(3) 。
23(10分)、(1) ; 。
(2) ;
。
24(14分)、(1) 。
(2)X ;Y 。
(3) ;
。
(4)对X的判断:
;
对Y的判断:
。
四、计算题(15分)
25、(6分)
26、(9分)
(1)V的范围 。
(2)O2的体积 mL。
(3)NO的体积 mL。
高三化学月考答题卷
一、选择题(4X18)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
二、填空题(63分)
19(10分)、(1) 、 、 ,
。
(2) 、 、 ,
。
20(6分)、(1)
。 (2) 、
。
21(12分)、(1) ;(2) ;
(3) ; ; 。
(4) ; ;
。
22(11分)、(1)X 、Y 、Z 。
(2) 、 。
(3) 。
23(10分)、(1) ; 。
(2) ;
。
24(14分)、(1) 。
(2)X ;Y 。
(3) ;
。
(4)对X的判断:
;
对Y的判断:
。
四、计算题(15分)
25、(6分)
26、(9分)
(1)V的范围 。
(2)O2的体积 mL。
(3)NO的体积 mL。