高三化学同步测试—《物质的量》
本试卷共计110分考试时间为90分钟
一.选择题(共16小题,每小题3分,每小题只有一个答案符合题意)
1.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同,体积相同的O2和H2
2.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.1.8g铵根离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液pH为14,又知电解后溶液总体积为1L,
则阴极析出的气体的分子数为0.5NA
3.在100mL0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL
溶有0.010molCuSO4·5H2O的溶液,充分反应.下列说法中正确的是 ( )
A.最终得到白色沉淀和无色溶液
B.最终得到白色沉淀是等物质的量的两种化合物的混合物
C.在最终的溶液中n(Cl-)=0.02mol
D.在最终的溶液中c(Cu2+)=0.01mol/L
4.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
5.下列实验中,①配制—定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发 ⑤溶解,均用到的仪器是 ( )
A.烧杯 B.漏斗 C.玻璃棒 D.胶头滴管
6.在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度.利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是 ( )
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
7.是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A 1︰1 B 2︰1 C 1︰2 D 2︰3
8、假如把质量数为12的碳原子(12C)的相对原子质量为24,并用以确定相对原子质量,以0.024kg12C所含的原子数为阿伏加德罗常数,下列数值: ( )
①浓H2SO4的物质的量浓度;②O2的溶解度;③气体摩尔体积;④阿伏加德罗常数;
⑤氧元素的相对原子质量;⑥32gO2在标况下的体积。 其中变成原来2倍的是:
A、①②⑥ B、②⑥ C、③④⑤ D、③④
9.某气体的摩尔质量为Mg·![]() ,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则
,N表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则![]() 表示的是 ( )
表示的是 ( )
A.以g为单位VL该气体的质量 B.以g为单位1L该气体的质量
C.1L该气体中所含的分子数 D.以L为单位1mol该气体的体积
10.下列叙述正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
11.在无土栽培中,需配制一定量含50 mol NH4Cl、16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A.2、64、24 B.64、2、24
C.32、50、12 D.16、50、24
12.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A.1 :1 :l B.2 :2 :1 C. 2 :3 :l D.4:3:2
13.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
14.若以![]() 和
和![]() 分别表示浓度为
分别表示浓度为![]() 和
和![]() 氨水的质量分数,且知2a=b,则
氨水的质量分数,且知2a=b,则
下列推断正确的是(氨水的密度比纯水的小) ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子
质量)为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
16. ![]() 代表阿伏加德罗常数值,下列说法正确的是
代表阿伏加德罗常数值,下列说法正确的是
A. 9g重水所含有的电子数为![]()
B. 1mol![]() 中含有离子数为
中含有离子数为![]()
C. ![]() 氯气与足量
氯气与足量![]() 溶液反应转移的电子数为
溶液反应转移的电子数为![]()
D. ![]() 分子中共价键总数为
分子中共价键总数为![]()
二、填空题(每空3分,共计48分)
17、一相对分子质量为M的可溶性盐RCl2,在一定温度下,将Wg该盐完全溶解在VmL水中,恰好饱和,所得溶液的密度为dg/cm-3,该温度下所得溶液的物质的量浓度 是 mol/L。
18、指出下列操作对实验结果的影响。(填写“无影响”、“偏大”、 “偏小”)
(1)欲配制0.1 mol·L-1 CuSO4溶液100 mL,取2.5 g胆矾在烧杯中溶解,然后倒入容量
瓶定容在100 mL,则浓度______________。
(2)用80% H2SO4加等体积水配40% H2SO4,则浓度_______________。
(3)用80% 酒精加等体积水配40%酒精,则浓度_______________。
19.在120 ℃时分别进行如下四个反应:
A.2H2S+O2 ==2H2O+2S B.2H2S+3O2 ==2H2O+2SO2
C.C2H4+3O2==2H2O+2CO2 D.C4H8+6O2==4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和 p前> p后的是____________;符合关系式d前=d后和 p前= p后的是__________________(请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和 V前<V后的是____________;符合d前>d后和 V前>V后的是_________________(请填写反应的代号)。
20.(9分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
21.(15分)现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的质量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L—1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道
。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。(不要求写计算过程)
三、计算题(14分)
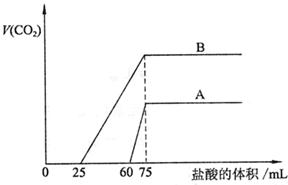
22.(14分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定
量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴
加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
|
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
参考答案:
一、选择题(共16小题,每小题3分,每小题只有一个答案符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | B | A | C | C | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | B | B | B | A | C | C | D |
二、填空题(每空3分,共计48分)
17 1000dw/M(W+V)
18、无影响、偏大、偏小
19.(1)B;C
(2)D;A
20.(1)3NH3+3Cl2 6NH4Cl+N2
(2)3:2 (3)![]()
21.(1)84:100(或21:25) (2)![]() (3)
(3)![]() (4)盐酸的物质的量浓度(其他合理答案也给分) 5)
(4)盐酸的物质的量浓度(其他合理答案也给分) 5)![]()
三、计算题(14分)
22.(14分)(1)(6分) NaOH、Na2CO3 3∶1 33.6
(2)(6分)Na2CO3、NaHCO3 1∶1 112
(3)(2分)
解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积
为75mL。
所以原NaOH溶液的物质的量浓度为:
![]()
(其它多理解法可得分)