高三化学选择题统测
一、选择题(本题包括9小题,每小题4分,共36分。每小题只有一个选项符合题意)
1、设NA为阿伏加德罗常数的值,下列说法正确的是( A )
A、lmolO22-含有18NA个电子
B、足量Na2O2和11.2LCO2反应,转移电子数目为NA
C、标准状况下,aLCH4和aL乙醇中所含的分子数均为NA
D、标况时,含原子个数相等的氢气和氦气所占的体积相等
2.意大利科学家最近合成一种新型氧分子,它由4个氧原子构成,专家认为它液化后的能量密度比普通氧分子高得多,下列关于该分子叙述正确的是 ( D )
A.它是氧元素的另一种同位素 B.它将成为一种新型强力火箭推进燃料
C.它的摩尔质量是64 D.它是氧气的另一种同素异形体
3.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也
有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( C )
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
4.下列化工生产过程中的反应,不涉及氧化还原反应的是( A )
A.用石灰石、石英、纯碱生产玻璃 B.用空气、水、煤制硝酸铵
C.用黄铁矿、磷矿石制过磷酸钙 D.以铝土矿为原料冶炼铝
5.希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:4Fe3++2H2O光照叶绿体4Fe2++4H++O2↑,下列有关该实验的说法错误的是( A)
A.反应后溶液的pH降低 B.每生成1 mol O2转移4 mol电子
C.叶绿体被氧化 D.该实验可说明光合作用产生的氧气来源于水
6.X、Y为短周期元素,X原子各电子层的电子数之比为1 :4 :1,它比Y原子多3个电子,下列叙述正确的是( C )
A.X离子半径大于Y离子半径 B.X、Y两元素位于同一周期
C.X单质在空气中燃烧可生成两种化合物 D.X、Y形成的化合物是共价化合物
7.某温度下,在一容积可变的容器中,反应2A(S)十B(g) ===2C(g);Q<0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是 ( C )
A.降低温度 B.加入催化效果更好的催化剂
C.A、B、C均增加1mol D.A、B、C的量均减半
8.25℃时,将pH=x的H2S04溶液与pH=y的NaOH溶液等体积混合,反应后所得溶液pH=7。若x=1/6y,则x值为 ( A )
A.2 B.3 C.4 D.5
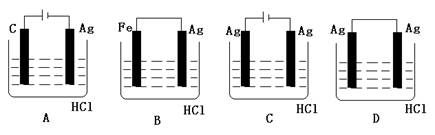 9.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是 ( C )
9.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是 ( C )
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
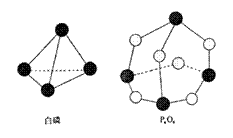 10.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)
P—P:198 P—O:360
O—O:498,则反应P4(白磷)+
3O2 → P4O6的反应热△H为 ( A
)
10.化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)
P—P:198 P—O:360
O—O:498,则反应P4(白磷)+
3O2 → P4O6的反应热△H为 ( A
)
A.-1638 kJ/mol B.+1638 kJ/mol
C.-126 kJ/mol D.+126 kJ/mol
11、多硫化钠Na2Sx(X≥2)在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl反应中,Na2Sx与NaClO的物质的量之比为1:16,则X值是 ( C )
A、5 B、4 C、3 D、2
12.下列各种溶液中能大量共存的离子组是 ( B )
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32-
C.pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.使紫色石蕊试液变红的溶液中:K+、Ca2+、Na+、HCO3-
13.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( BD )
A.向CuSO4溶液中加入适量铁粉
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.在NaI溶液中通入过量氯气
14.下列反应的离子方程式书写正确的是( A )
A.漂白粉溶液中通入二氧化硫
Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
B.向氯化铝溶液中加入过量氨水
![]()
C.碳酸钡溶于醋酸溶液
![]()
D.三氯化铁的酸性溶液中通入足量的硫化氢
![]()
15.将0.2 moL/L的CH3COONa溶液与0.1 mol/L的硝酸溶液等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是 ( AD )
A.c(CH3COO-)+c (NO3-) +c (OH-) = c (H+) + c (Na+)
B.c(CH3COO-)= c (Na+)= c (NO3-)> c(CH3COOH)> c (H+)
C.c(CH3COO-)> c(NO3-)> c(CH3COOH) = c(Na+) >c(H+) > c (OH-)
D.c (Na+)>c(CH3COO-)> c (NO3-)>c(CH3COOH) >c (H+)> c(OH-)
16.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,当有n mol电子转移时,下列说法不正确的是 ( AD )
A.有2n mol (NH4)2SO4分解 B.有![]() 原子被还原
原子被还原
C.生成![]() 氧化产物 D.生成7n mol H2O
氧化产物 D.生成7n mol H2O
17.氯酸(HClO3)是一种强氧化性酸。若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是( BD
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
18.L-多巴是一种用于治疗帕金森氏综合症的药物,其结构简式如下:
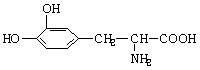
下列关于L-多巴的性质推测正确的是( A )
A.能跟氢氧化钠溶液反应 B.不能跟溴水发生取代反应
C.不易被氧化剂氧化 D.不可能形成高分子化合物
答案
1、A 2、D 3、C 4、A 5、 A 6、 C 7、C 8、A 9、C
10、A 11、C 12、B 13、BD 14、A 15、AD 16、AD 17、BD 18、A