高三化学与数学的结合1
化学计算解题过程,主要是化学知识的运用过程即结合题目条件利用物质的组成、结构、性质和变化规律建立联系,在解题过程中合理使用数学工具可以取得良好效果。
1.利用二元一次方程组解题
有关混合物计算是高中化学中常见的类型,其解题过程大体可分为两个阶段,第一阶段利用化学知识找出题目中各物质或量的关系,第二阶段利用关系列出方程计算得出结果。值得指出的是化学计算中十字交叉法、差量法均是二元一次方程组独特的运算方法。
例1 元素X和Y在周期表中位于相邻的两个周期,X和Y两原子的核外电子数之和为19,Y原子的原子核内质子数比X多3个,则下列叙述不正确的是 [ ]
A.X和Y都是化学性质很活泼的元素,它们在自然界中只能以化合态存在
B.X和Y形成的化合物的化学式可以是Y2X2
C.元素X形成的化合物种类比元素Y形成的化合物种类多
D.Y的单质能置换出盐酸中的氢,不能置换出稀CuSO4溶液里的Cu2+
解析:设元素X和Y核外电子数分别为x和y,根据题目条件,列二元一次方程组
![]()
这是将化学关系抽象成数学模型、利用数学工具解决化学问题的解题过程。
答案:A
例2 取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g。冷却后加入足量的水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学反应方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
设:燃烧后生成氮化镁xmol。氧化镁ymol。
根据镁原子守恒Mg3N2~3Mg
![]()
解得x=0.0008,氮化镁的质量分数为:17.0%。
例3 1993年报道的合成烃中,有一种烃A为C1134H1146,其分子中只含有三种结构单元(Ⅰ—Ⅱ):
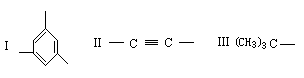
化学式为CnHm的烃,若m<2n+2,则该烃及该烃的烃基就具有一定的不饱和度(也叫缺氢指数),化学式为CnHm的烃的不饱和度计算式为(2n+2-m)/2;如A的三种结构单元中(Ⅰ)的不饱和度为4,(Ⅱ)的不饱和度为2;(Ⅲ)的不饱和度为0。试求:
①A分子中有上述结构单元Ⅰ、Ⅱ、Ⅲ各多少个?
②若另一种烃B的化学式为C1398H1278,则其不饱和度为多少?
分析:本题可用列三元一次方程组的方法解题
①设:(Ⅰ)、(Ⅱ)、(Ⅲ)单元各为x个、y个、z个
![]()
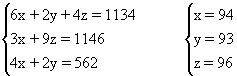
![]()
2.利用排列组合解决化学问题
在分析化学组成、结构单元等问题时可以利用排列组合的知识将具体问题抽象化,可以简化解题过程。

A.1 B.3 C.5 D.6
答案:D、C
例5 现有10种α-氨基酸,①能构成多少有三个不同氨基酸单元的三肽?②能构成多少种只有两种不同氨基酸单元的三肽?
解析:根据数学中的排列组合知识,确定此题属于有序性排列。

3.利用等差数列、极值解决化学问题
例6 在沥青中含有稠环的芳烃,其中偶数个苯的可视为同系物,如:
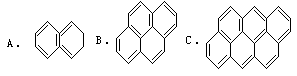
①求第25个分子的分子式;
②求含碳量的极限。
解析方法1:①经观察分析 A、B、C分子式分别为C10H8、C16H10、H22H12碳原子数和氢原子数递增呈等差数列,由通项公式an=a1+(n-1)d,求出该一系列有机物的通式;C原子数:公差为6,首项是10,an=a1+(n-1)d=10+(n-1)×6=6n+4。
H原子数:公差是2,首项是8an=a1+(n-1)d=8+(n-1)×2=2n+6。
所以通式为C6n+4H2n+6,第25个分子的分子式为C154H56。
②求含C量的极限
方法2:求含C量的极限
因为n趋于无穷大
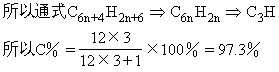
例7 有一系列α-氨基酸按如下特点排列:
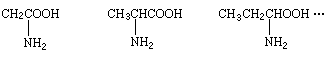
该系列化合物中碳元素的质量分数的最大值为 [ ]
A.32% B.46.6%
C.85.7% D.无法确定

![]()
4.利用等比数列解决化学问题
例8 一定的条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积为原总体积的 [ ]
A.1/4 B.3/4
C.1/8 D.3/8
解析:设 NO和O2的物质的量均为n。则反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO可知,nmolNO与n/2molO2反应生成n molNO2,溶于水后得n/3molNO;n/3molNO与n/6molO2反应生成n/3 molNO2,溶于水后得n/9molNO;……继续反应下去,总耗O2量为下列等比数列各项之和:n/2,n/6,n/18…n/(2×3k-1),依等比数列的求和公式,得总耗氧量S=(n/2)/(1-1/3)=3n/4,剩余O2为n-3n/4=n/4mol,则剩余O2的体积为原总体积的1/8。故正确答案为C。
说明:此题也可以用其他的方法来求解。
5.利用不等式解题
根据题设条件求最大值或最小值,从而确定取值范围来解决问题,解题过程中往往可根据某种物质组成的有或无来确定最大值或最小值,有时也可以依据方程式来确定。
例9 今有10.8g碱金属M及其氧化物M2O的混合物与水反应,生成碱16g,则M为
A.Li B.Na
C.K D.Rb
解析:假设10.8g全部是碱金属M,根据2M+ 2H2O=2MOH+H2解得M的相对原子质量小于35。
假设10.8g全部是碱金属氧化物M2O。
根据M2O+H2O=2MOH解得M的相对原子质量大于11,所以碱金属相对原子质量在11~35之间。
答案:B
例10 A、B两种化合物的溶解度曲线如图7-1。现要用结晶法从A、B的混合物中提取A。(不考虑A、B共存时,对各自溶解度的影响)
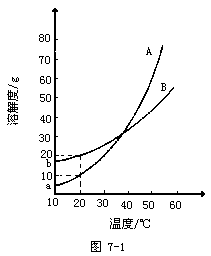
(1)取50g混合物,溶于100g热水中,然后冷却到 20℃,若要使A析出而B不析出,则要求混合物中B的质量最高不超过多少?
(2)取Wg混合物,溶于100g热水,再冷却至10℃。若仍要A析出而B不析出,请写出在以下两种情况下,混合物中A的质量分数(A%)应满足的条件?(以W、a、b表示)
当w<a+b时,A%______;
当W>a+b时,A%______。
分析:当W>a+b时,只有WB≤b,B才不至于析出,-WB≥-b,两边均加W导出W-WB≥W-b,因为W-WB=WA,
所以WA≥W-b,两边同除以W得出答案。
答案:(1)WB≤20g(2)A%>a/W A%≥(W-b)/W
例11 在一个容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应,各物质的起始加入量如下:A、B C均为4.0mol,D为6.5mol,F为2.0mol。设E为xmol, x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。填写下列空白:
![]()
(1)若x=4.5,则右侧反应在起始时向______方向进行。欲使起始反应维持向该方向进行,则x的取值范围为______。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
分析:根据题意列出6.5-a+x-2a+2+2a=12
x-2a>a且a>0
x=3.5+a
保持平衡向正向移动的前提下解得x>3.5。
答案:(1)正;3.5~7.0(2)不等;温度不同,平衡状态不同。
例12 若A是相对分子质量为128的烃,则其分子式只可能是______。若A是易升华的片状晶体,则其结构简式为:______。
解析:设烃的分子式为CxHy,相对分子质量为M,则M=12x+y;y=M-12x。因为y/2(任何烃分子中的氢原子数大于2,只有乙炔分子中氢原子数等于2),因为y≤2x+2(任何烃分子中的氢原子均不能大于其碳原子数的两倍加2),得不等式2≤M-12x≤2x+2。
![]()
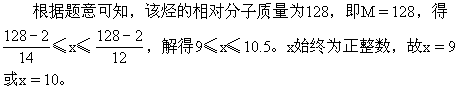
即A的分子式为C9H2O或C10H8。
由题中所给的已知条件看,解题所得的两种物质,能升华的片状晶体只能是萘,则其分子式只能是C10H8,其结构简式为 ![]() 。
。
例13 已知氟化氢气体中存在着下列平衡2(HF)3 ![]() 3(HF)2,(HF)2
3(HF)2,(HF)2 ![]() 2HF。
2HF。
若平衡时气体的平均摩尔质量是42g/mol,试通过论证(HF)3的体积分数必大于10%。
解析:解题的前提是相同的条件下,混合气体中各组分的体积分数等于其物质的量分数。
解法1:设(HF)3占体积分数为x,(HF)2占的体积分数为y,HF占1-x-y。
60x+40y+20(1-x-y)=42
2x+y=1.1,因为1-x-y>0,x+y<1。故x=1.1-(x-y)>0.1,即(HF)3的体积分数必大于10%。
解法2:设(HF)3占x,(HF)占y,(HF)2占1-x-y。
60x+40y+40(1-x-y)=42,x-y-0.1,因为y>0,所以x>0.1,即(HF)3的体积分数必大于10%。
解法3:用反证法:①设(HF)3的体积分数等于10%,HF的体积分数为x,(HF)2的体积分数为0.9-x,则:60×10%+40(0.9-x)+20x=42,x=0,而x不可能为零,故(HF)3的体积分数不等于10%。
②设(HF)3的体积分数小于10%。
则有40(0.9-x)+20x>36,x<0不合理,故(HF)3的体积分数不可能小于10%,综合①、②结论,(HF)3的体积分数必大于10%。