理科综合题(一)高三化学与物理的结合1
物理和化学综合能力测试内容要求:(1)通过试验观察自然现象,根据图表、图形、数据解释说明有关概念或图示的相关概念。(2)应用所学的知识对自然现象进行系统的分析和多角度、多层次的描述。(3)正确评价人与自然的关系。(4)体现生态安全的可持续发展的价值取向。
综合上述测试内容要求,物理和化学综合能力测试将主要在自然现象、原子核及原子结构、气态物质的物理及化学变化、环境保护和人类生存条件、工农业生产和生活实际、新能源、新材料、现代科技及现代生活等交叉和渗透及综合知识(课题),凡是与这一课题相关的知识都会成为理化综合测试题命题的热点。
1.电学
氧化还原反应是中学化学内容重要组成部分,氧化还原过程中伴有电子转移发生,电子转移或移动恰好是物理学中的电学中的内容,通过电子转移将二者联系起来。原电池(或电解池)为氧化还原反应的重要的应用,形成原电池(或电解池)时负极(或阳极)失电子总数和正极(或阴极)得电子总数相等,电子转移成为它们的桥梁,可以通过此桥梁求解相关的量;在有电场存在下正负电荷分别向高电势和低电势方向移动成为物理学与化学的又一结合点。
例1 两根镍棒分别与电源正、负极相连,并都插入NiSO4溶液中,若电流强度为I,通电时间为ts,结果阳极质量减少mg。已知每个电子的电量为1.6×10-19C,则可推知阿伏加德罗常数为______。
解析:本题金属作为阳极,由单质变成Ni2+失电子总数和导线中电子流动总数相等形成解题的桥梁。
![]()
求得:NA=(58.69×I×t)/(1.6×10-19×2m)
例2 100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH·2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同的温度下每100g溶液中无水氢氧化钾的质量为:

求温度T,给出计算过程,最后计算结果只要求两位有效数字。
注:法拉第常数F=9.65×104C/mol,相对原子质量:K39.1 O16.0 H1.01
解析:此题为物理学和化学相结合,根据电解规律可知,电解KOH相当于电解水,阴阳两极得失电子总数和电路中转移电子数相等,此为解题的关键。电解反应是水分解为氢和氧。时间10.00h,电流强度6.00A,总共提供电量Q=It=216×103C,相当于2.24mol电子,每电解1mol水需电子2mol,故有1.12mol水,即20.1g水被电解。从剩余溶液的总质量可知有35.2g物质离开溶液,其中有20.1g水被电解,故结晶的KOH·2H2O的质量为15.1g。故:

![]()
根据溶解度数据,T应在20~30℃之间,故溶解度与温度的线性关系方程式为:
T=20℃+(55.1-52.8)/(65.8-52.8)×10℃=28℃
例3 某学生试图用电解法根据电极上析出物质的量来验证阿伏加德罗常数,其实验方案的要点为:
1.用直流电电解氯化铜溶液,所用的仪器如图7-9。
2.在电流强度为IA,通电时间为ts后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注的仪器接线柱的英文字母表示。下同):
E接______,C接______,______接F。
实验装置线路中的电流方向为______→______→______→______→______→______。
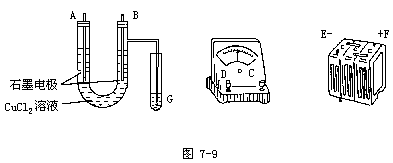
(2)写出 B极发生反应的离子方程式______,G试管中淀粉KI溶液变化的现象为______,反应的离子方程式为______。
(3)为精确测定电极上析出铜的质量,所必须的实验步骤的先后顺序应是______(选填下列操作步骤的编号)。
①称量电解前电极的质量②刮下电解后电极上的铜③用蒸馏水冲洗电解后电极④低温烘干电极后称量⑤高温烘干电极后称量⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算表达式:
NA=______。
解析:该题要求用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,是将物理和化学有机融合在一起的试题。它改变了化学实验考核仅仅是玻璃仪器连接的考法,不仅要求学生能正确地把电解装置中电解池和直流电源相连接,而且要求在电解装置中串联一只电流表。此题最后给出了电子的电量,要求根据电解后电极上析出铜的质量。列出阿伏加德罗常数的计算公式。
(1)连接这些仪器的正确顺序为E接D,C接A,B接F。
连接的实物图如图7-10。
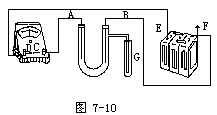
实验装置线路中的电流方向为F→B→A→C→D→E。
(2)写出B极发生反应的离子方程式2Cl--2e→Cl2↑,G试管中淀粉KI溶液变化蓝色,相应的离子方程式Cl2+2I-=2Cl-+I2。
(3)为精确测定电极上析出铜的质量,所必须的实验步骤的先后顺序应是①、③、④、⑥。
本实验的最终目的是正确的称量电极上析出铜的质量,因此,电解前必须正确称量电极的质量,电解完成后,正确地称量电解的增加值,是关键的一步。它首先要用蒸馏水清洗电极上残留的铜离子和氯离子,然后要烘干洁净的电极,但是要注意不能在较高的温度下操作,否则电极上的铜易被氧化,造成称量的误差。为了避免称量中的误差,对电极要再次低温烘干后称量至恒重。
(4)已知电子的电量为1.6×10-19C。在单位时间内电路中通过的总电量为Q=It。铜失电子总数和电路中通过电子总数相等。

![]()
例4 由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子化合价a的乘积,其比例系数F是一个恒量,称为法拉第常数,它与金属的种类无关。
已知:阿伏加德罗常数NA=6.023×1023 mol-1,电子电量e=1.60×10-19C
Cu的原子量:64×10-3kg·mol-1
①如果电解硫酸铜溶液获得1kg的金属铜,通过电解槽的电量是多少?
②用电铰的方法在半径为R的钢球壳表面均匀的镀上很薄的银层,在电镀槽中钢球是阳极还是阴极?另一电极是什么材料?若电流强度为I,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度 d(其他用本题中的符号表示,法拉第常数为9.64×104C·mol-1)。
解析:此题中涉及到内容有物理、化学,还有数学等相关的知识,是一道综合性很强的题目。①解答的关键是铜失电子总数等于电路中电子总数,②解答线索是通过电路中提供的电量,可求得析出银的总质量,同时mAg=ρV=4πR2dρ,即可以求出d。
![]()
电量Q=Fan=9.64×104×2×15.6=3.0×106C
②钢球是阴极,阳极材料是银
由电解定律,It=Fan,此题中,银,a=1
![]()
![]()
例5 图7-11所示,A与B试管中的电极为多孔的惰性电极;c和d为夹在湿的Na2SO4滤纸条上的铂夹;电源有a和b两极。若在A和B试管中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭K2和K3,通过直流电,则:
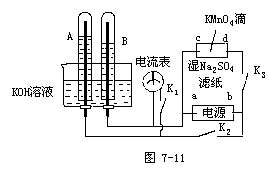
①在湿的Na2SO4溶液滤纸条上的中心的KMnO4液滴,观察到的现象是______,理由是______。
②标出电源的正、负极,a为______极,b为______极。
③写出电极反应式:A中______,B中______。
④若电解一段时间后,A和B中均有气体包围电极。此时切断K2和K3,闭合K1,则电流表的指针______(填“会”或“不会”)移动。
⑤若电流表的指针不移动,说明理由;若指针移动,也说明理由(均可用反应式表达)。
解析:此题将物理学中带电粒子在电场中的移动、并联电路、欧姆定律和电极反应化学知识等结合起来,是一道横跨物理和化学综合性很强的题目。本题的解题关键有两点:(1)电解氢氧化钾溶液相当于电解水;(2)负电荷在电场中向高电势方向移动。电解反应中阴阳两极得失电子总数相等时产生的氢气体积是氧气体积的二倍,电解时阳极出氧气,阴极出氢气可以判断a、b电极的正负情况,通过a、b的正负
![]()
答案:
![]()
②负;正③A中:4OH--4e=2H2O+O2↑B中2H++2e=H2↑
④会⑤因A中的O2,B中的H2与KOH溶液形成H2、O2燃料电池。
电极反应为:
A:O2+4e+2H2O=4OH- B:2H2-4e+4OH-=2H2O
2.力学
由阿伏加德罗定律可知同温、同体积条件下气体的物质的量之比等于压强之比,由此可知气体的物质的量和物理学压强联系起来形成物理、化学知识的一个结合点;解决此类问题必须找出二者之间的联系,从而建立关系。
例1 高中化学中,有些知识点的学习只有联系物理或数学的知识才能加深理解,如要掌握“喷泉实验”,还必须弄清以下几个问题:(1)是否只有水溶性很大的气体才能形成喷泉?(2)多大溶解度的气体才能形成喷泉?(3)喷泉实验成败的关键是什么?除了课本中的实验装置外能否采用其他装置?这里就要应用物理学中有关压强知识来研究分析。
解析:设实验时所用的烧瓶容积为250mL,玻璃导管长35cm,胶头滴管内能够挤出约0.5mL的水,可用压强知识计算出胶头滴管挤出0.5mL水溶解气体的最小体积数。要使水顺利喷出,瓶内外的压强差必须超过一个特定的值,即这个压强差(设为△p)必须克服玻璃导管水柱的重力作用才能使水顺利压入烧瓶。由压强知识知:1个大气压相当于由10.34m高的水柱产生的压强,则有:1atm/10.34m=△p/0.35m,△p=0.034atm,即烧瓶内气体压强至少减少至 0.966atm。由道尔顿分压定律p总V分=p分V总,得:1atm×V=0.034atm×250mL,所以V=8.5mL。即此压强差△p相当于由8.5 mL气体所产生的压强,水就可以喷出。由此可知,当气体的溶解度大于或等于17左右时,就有可能形成喷泉。进而就可得出,诸如HBr、HI、SO2等气体均可以做类似的喷泉实验,还有像二氧化碳、氯气等气体也可以用氢氧化钠溶液做吸收液来做喷泉实验。
例2 如图7-12所示装置。玻璃匙盛硫,金属丝用于加热(不和硫反应),容器内盛氧气,U形管内盛汞,反应前两侧汞液面持平,给金属丝通电加热使硫起反应。反应完成后使容器内的温度恢复到反应前的温度,U形管两侧汞液面仍持平。
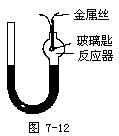
(1)由实验结果能得到结论是______。
(2)若反应前后容器内盛空气或N2O。分别如上实验并恢复到原温度时(已知二者反应后容器内所含物质种类相同,空气看作由N2和O2组成),U形管两侧汞面情况(用化学方程式表示并简单说明):
①盛空气汞液面______(是、否)持平,原因______。
②盛N2O汞液面______(是、否)持平,原因______。
解析:此题为阿伏加德罗定律内容的引申,压强由U型管两侧汞柱高度表示出来,从实验结果两侧汞液面持平(即压强不变)可以推知反应前后气体体积不变,硫单质为固体体积可以忽略不计,满足体积不变,也就是每消耗1molO2就得生成1mol气体。空气看作由N2和O2组成,N2和S不发生反应,硫和氧气发生反应S+O2=SO2,反应前后气体的物质的量不变,因此汞液面持平;从题目信息二者反应容器内所含物质种类相同可知N2O和S反应的产物为N2和SO2,化学方程式为S+2N2O=2N2+SO2,可以看出反应前后气体物质的量不同,因此汞液面不持平。
答案:
(1)反应前后气体体积不变,每消耗1molO2就得生成1mol气体。
(2)①是;S+O2=SO2,反应前后气体的物质的量不变。
②否;2N2O+S=2N2+SO2,反应前后气体的物质的量改变。
例3 在一烧杯中盛有100mL2mol·L-1的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图7-13所示)。向该烧杯里缓缓注入0.4 mol·L-1的 Ba(OH)2溶液至恰好完全反应,在此实验过程中:
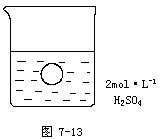
(1)烧杯里观察到的实验现象有:
①______
②______
(2)写出实验过程中的反应的离子方程式______。
解析:此题将物理学中的浮力和化学反应后产物的变化联系起来,反应前是硫酸溶液,当加入Ba(OH)2溶液后,发生反应而变成水溶液,BaSO4是不溶物,硫酸的密度比水的密度大。物体悬浮在溶液中的条件是溶液的密度和物体的密度相等,变成水溶液后,水的密度小于物体的密度,所受水的浮力小于物体所受的重力,物体下沉。
答案:
(1)①溶液里产生白色沉淀 ②小球沉至烧杯底部(或小球下沉)
![]()