高三化学质量检测
化 学
试卷满分共150分,考试时间120分钟.
相对原子质量:H—l C—12 O—16 S—32 Cl—35.5 K—39 Fe—56
第Ⅰ卷
一、本题包括5个小题,每小题4分,共20分,每小题只有一个选项符合题意
1.加碘食盐不是在食盐中加单质碘,而是添加少量的碘的化合物.1990年我国政府以国家标准方式规定民用食盐的碘的添加剂碘酸钾,不再使用碘化钾的原因是( )
A.![]() 的含碘量大于碘化钾
的含碘量大于碘化钾
B.KI味涩苦,在空气中易被氧化而变质
C.KI有毒不能食用
D.碘化钾不稳定易分解
2.研究证明,在活的生物体内C的放射性同位素![]() 会在其体内不断衰变而减少.因此,考古人员可通过测定古生物化石中
会在其体内不断衰变而减少.因此,考古人员可通过测定古生物化石中![]() 的含量而确定古生物生活的年代,下列有关
的含量而确定古生物生活的年代,下列有关![]() 的叙述中正确的是( )
的叙述中正确的是( )
A.与![]() 为同素异形体 B.与
为同素异形体 B.与![]() 互为同位素
互为同位素
C.与![]() 含的中子数相同 D.与
含的中子数相同 D.与![]() 化学性质不同
化学性质不同
3.下列化合物中既含有离子键又含有极性共价键的是( )
A.NaBr B.![]() C.KI D.
C.KI D.![]()
4.在化学上,常用![]() 作为制取氢气的药剂,有关反应的化学方程式为
作为制取氢气的药剂,有关反应的化学方程式为![]() ,在这个反应中,
,在这个反应中,![]() 的作用是( )
的作用是( )
A.是还原剂 B.是氧化剂
C.是溶剂 D.既不是氧化剂,也不是还原剂
5.在下列现象中,与电化学腐蚀无关的是( )
A.钢铁在潮湿空气中很快被腐蚀
B.铁器上附有铜件时在接触处易生锈
C.生铁比纯铁容易生锈
D.银制品久置后表面变暗
二、本题包括10小题,每小题4分,共40分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分
6.在下列物质的浓溶液中通入![]() ,溶液变浑浊的是( )
,溶液变浑浊的是( )
A.苯酚 B.苯酚钠
C.偏铝酸钠 D.氯化钙
7.向![]() 胶体中滴加一种液体后,胶体首先发生凝聚而沉淀,继续加入该液体时沉淀消失.这种液体是( )
胶体中滴加一种液体后,胶体首先发生凝聚而沉淀,继续加入该液体时沉淀消失.这种液体是( )
A.0.5mol/L盐酸 B.0.5mol/L![]()
C.0.5mol/LKCl D.![]()
8.对于某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的转化率 B.以同等程度改变正逆反应的速率
C.改变平衡混合物的组成 D.增大正反应速率,降低逆反应速率
9.无色透明的酸性溶液中,可能大量含有的离子组是( )
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
10.下列各说法中正确的是( )
A.凡是能发生银镜反应的物质都是醛
B.乙烯和甲苯都能使酸性![]() 溶液褪色
溶液褪色
C.在氧气中燃烧只生成二氧化碳和水的有机物一定是烃
D.苯酚具有弱酸性,它是一种羧酸
11.常用的锌锰干电池在放电时总反应可表现为:
![]()
放电时,正极区发生反应的物质或微粒是( )
A.锌 B.只有二氧化锰
C.二氧化锰和铵根离子 D.锌离子和氨分子
12.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下).它在光照的条件下与氯气反应能生成三种不同的一氯取代物,该烃的结构简式是( )
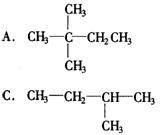
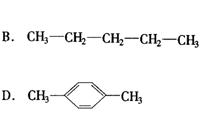
13.X、Y、Z是周期表中三种相邻的元素,X和Y同周期,Y和Z同主族,这三种元素原子的最外电子层中电子数总和为17,核内质子数的总和是31,则X、Y、Z三种元素是下列各组中的( )
A.N、O、S B.O、S、P
C.O、F、Cl D.C、Si、P
14.下列物质中的杂质(括号内为杂质)的除去方法,正确的是( )
A.![]() 溶液:加入足量铁粉,充分反应后取上层清液
溶液:加入足量铁粉,充分反应后取上层清液
B.![]() :通过足量灼热的CuO粉末
:通过足量灼热的CuO粉末
C.![]() :加入足量NaOH溶液,振荡、静置、分液
:加入足量NaOH溶液,振荡、静置、分液
D.![]() :分液
:分液
15.1molX气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() bZ(g)
bZ(g)
反应达到平衡后,测得X的转化率为50%,而且同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=2
第Ⅱ卷
三、本题有两个小题,共28分
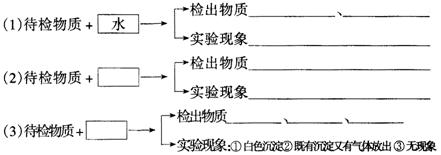
16.(10分)有6瓶白色固体,它们分别是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、无水
、无水![]() .现仅有用蒸馏水及已被检出的物质对它们作出检验.根据以下实验步骤,在空格内填入须加入的试剂.填写检出物质时须与实验现象上下对应.
.现仅有用蒸馏水及已被检出的物质对它们作出检验.根据以下实验步骤,在空格内填入须加入的试剂.填写检出物质时须与实验现象上下对应.
17.(18分)利用如图装置,选用适当试剂,可完成实验A、B、C,并得出相应的实验结论,实验所用试剂或所得结论列于表中
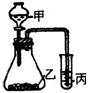
| 实验 | 所用试剂 甲 乙 丙 | 实验结论 |
| A | ① 高锰酸钾 ② | 氧化性 |
| B | 盐酸 石灰石 苯酚钠 | ③ |
| C | ④⑤⑥ |
|
(1)请将表③—⑥应填写的内容填在下面空格内
①浓盐酸②溴化钠溶液③________ ④________ ⑤________ ⑥________
(2)请利用上述装置另设计一有机化学实验.填写甲、丙中药剂,丙中现象及由此得出的结论
药剂:甲________,乙![]() ,丙________
,丙________
丙中观察到的现象:______________________________________________________
由此实验得出的结论:____________________________________________________
四、本题包括三小题,共27分
18.(11分)![]() 、
、![]() 、
、![]() 、D、E5种(分子或离子)粒子,它们都分别含有10个电子,已知它们有如下转化关系:
、D、E5种(分子或离子)粒子,它们都分别含有10个电子,已知它们有如下转化关系:
①![]() ②
②![]()
据此回答下列问题
(1)写出这5种粒子的化学式:
![]() ________,
________,![]() ________,
________,![]() ________,D________,E________.
________,D________,E________.
(2)![]() 和
和![]() 的电子式_______________、_____________________
的电子式_______________、_____________________
(3)![]() 、D、E3种粒子结合质子(
、D、E3种粒子结合质子(![]() )的能力由强到弱的顺序是(用粒子的化学式表示这一顺序,并用离子方程式说明原因):
)的能力由强到弱的顺序是(用粒子的化学式表示这一顺序,并用离子方程式说明原因):
①___________________________________________________________________
②___________________________________________________________________
19.(8分)在一定条件下可实现如下图所示物质之间的相互转变:
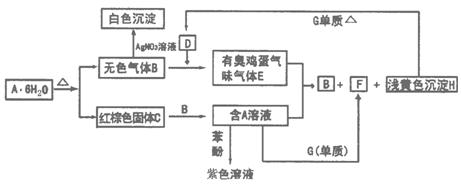
(1)根据你的推测,请填写下列物质的化学式:
A_______________________________________________________________________
B_______________________________________________________________________
D_______________________________________________________________________
G_______________________________________________________________________
(2)简要说明A可能变为B和C的原因,写出有关反应的化学方程式
________________________________________________________________________
(3)写出E气体与A溶液反应的离子反应方程式:
________________________________________________________________________
20.(8分)1000℃时,在密闭容器中加入一定量的![]() 固体使其发生以下反应并达平衡
固体使其发生以下反应并达平衡
![]()
![]()
![]() ;DH=+Q(表示反应吸热)
;DH=+Q(表示反应吸热)
在恒温恒容时回答以下问题:
(1)向容器分别加入以下物质,对平衡有无影响,有影响的应写出平衡移动的方向.
①加入![]() ________ ②加入焦炭________
________ ②加入焦炭________
(2)若初时加入的![]() 是1.42g,平衡时容器中固体物质的质量是1.10g,
是1.42g,平衡时容器中固体物质的质量是1.10g,![]() 的转化率是____________________
的转化率是____________________
(3)若将容器温度升高20℃,![]() 在混合气体中的含量变化是________________趋势.
在混合气体中的含量变化是________________趋势.
五、本题包括两小题,共16分
21.(5分)四种有机物A、B、C、D分子式均为![]() ,把它们分别进行实验并记录现象如下:
,把它们分别进行实验并记录现象如下:
| NaOH溶液 | 银氨溶液 | 新制 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
四种物质的结构简式为
A________________ B________________或________________
C________________ D________________
22.(11分)阿斯匹林(AsPPrin)是应用最广泛和最成功的合成药物,具有解热、抗炎和镇痛等作用,(已知有![]() 可在苯环上引入羧基)合成过程包括以下操作程序:
可在苯环上引入羧基)合成过程包括以下操作程序:
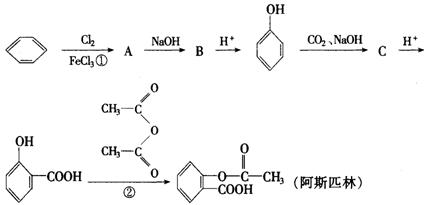
回答下列问题
(1)写出A、B、C的结构简式
A________ B________ C________
(2)写出C与![]() 水溶液反应的反应式:________.
水溶液反应的反应式:________.
(3)①的反应类型属于________反应.反应②可看作是________反应,在此反应中为提高产率,用乙酸酐(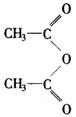 二分子乙酸脱去一分子水的产物)代替乙酸,其原因是________.
二分子乙酸脱去一分子水的产物)代替乙酸,其原因是________.
(4)阿斯匹林药片需保存在干燥处,返潮的药片便不能服用,检验其是否变质最灵敏的试剂________.
六、共19分
23.已知![]() 在
在![]() ℃时的溶解度为50g,向该温度下的
℃时的溶解度为50g,向该温度下的![]() 饱和溶液300g中加入148g一定浓度的硝酸,恰好完全反应,求
饱和溶液300g中加入148g一定浓度的硝酸,恰好完全反应,求
(1)反应前该饱和溶液中![]() 的物质的量是多少?
的物质的量是多少?
(2)完全反应后得![]() 溶液的质量分数是多少?
溶液的质量分数是多少?
24.FeS能跟盐酸反应生成![]() 气体和
气体和![]() .把8.8g FeS放入200mL2.0mol/L的盐酸中,以制备
.把8.8g FeS放入200mL2.0mol/L的盐酸中,以制备![]() .反应完全后,若溶液中
.反应完全后,若溶液中![]() 的浓度为0.01mol/L,假定溶液的体积不变,试计算
的浓度为0.01mol/L,假定溶液的体积不变,试计算
(1)收集到的![]() 的体积;
的体积;
(2)溶液中![]() 的浓度.
的浓度.
参考答案
1.B 2.B 3.B 4.B 5.D 6.BC 7.A 8.B 9.C 10.B 11.C
12.B 13.A 14.AC 15.AD
16.(1)![]()
![]() 溶液呈蓝色 不溶于水的白色固体
溶液呈蓝色 不溶于水的白色固体
(2)![]()
![]() 生成淡蓝色沉淀
生成淡蓝色沉淀
(3) ![]()
![]() 、
、![]() 、
、![]()
17.(1)③![]()
![]() ④浓
④浓![]() ⑤亚硫酸钠 ⑥品红溶液
⑤亚硫酸钠 ⑥品红溶液
(2)甲:水 丙:溴水 现象:溴水的橙色(或红棕色)褪去 结论:乙炔分子中含不饱和碳碳键
18.(1)
![]() :
:![]()
![]() :
:![]()
![]() :
:![]() D:
D:![]() E:
E:![]()
(2)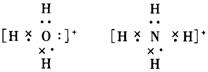
(3)①![]() ②
②![]()
19.(1)A ![]() B HCl D FeS G Fe
B HCl D FeS G Fe
(2)![]()
![]()
![]()
加热时![]() 的水解程度加深,生成的HCl气体挥发,使平衡向右移动.
的水解程度加深,生成的HCl气体挥发,使平衡向右移动.
(3)![]()
20.(1)①平衡不移动 ②平衡向正反应方向移动 (2)5%
(3)随着温度的升高![]() 的百分含量渐小的趋势或随着时间的延长,
的百分含量渐小的趋势或随着时间的延长,![]() 的百分含量渐小的趋势
的百分含量渐小的趋势
21.A ![]() B
B ![]() 或
或![]() —
—![]() —
—![]() —CHO
—CHO
C ![]() D
D ![]()
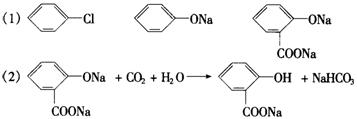
22.
(3)取代 酯化或取代 增大醋酸的浓度,使化学平衡向正反应方向移动
(4)![]() 溶液
溶液
23.解:设![]() 饱和溶液中
饱和溶液中![]() 为x.
为x.
(100+50)∶50=300∶x x=100克 ∴ ![]()
由原子守恒知生成![]() 1mol,生成
1mol,生成![]() 气体1mol
气体1mol
![]()
1mol 1mol 1mol
1mol 1mol 1mol
∴ ![]()
24.解:设![]() 的体积为x
的体积为x
![]()
1mol 2mol 22.4L
![]() 0.2×2=0.4 x
∴ HCl过量
0.2×2=0.4 x
∴ HCl过量
1∶22.4=0.1∶x x=2.24L
∴ V=2.24-0.2×0.01×2.24=2.24-0.048=2.1952(L)
(2)![]()