高三化学专题练习——推断题
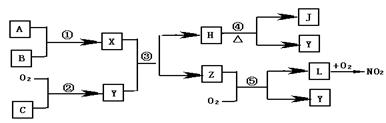
1.下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体其余均为气体。根据图中关系推断:
 |
(1)化学式X A B
(2)写出C→E的化学反应方程式
(3)实验室收集气体D和F的方法依次是 法和 法。
2分)有X、Y、Z三种单质,X是金属,常温下Y是液体,Z是气体,反应关系为:
 |
(1)据此推断X、Y、Z的化学式为:X_________,Y_________,Z__________。
(2)C+Y→A的离子方程式:___________________________________________
(3)X元素的核电荷数小于36,它是不是主族元素,简述理由。
___________________________________________________________________________
________________________________
 3.(6分)下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
3.(6分)下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
(1)A与B按物质的量之比n(A)∶n(B)=1∶2完全反应生成G
(2)B与C按物质的量之比n(B)∶n(C)=3∶1完全反应生成F
(3)C与D按物质的量之比n(C)∶n(D)=1∶3完全反应生成E
请填空:
(1)物质B是 ,物质D是
(2)B与C反应生成F的化学方程式为:
(3)A与H反应生成I的化学方程式为: 。
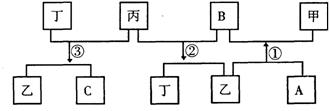 4. (10分)有 A、B、C、D四种单质,在一定条件下,A、B、C分别跟 D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
4. (10分)有 A、B、C、D四种单质,在一定条件下,A、B、C分别跟 D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:
(1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
(3)反应①的化学方程式是 。
5.(14分) A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水
解可生成两种碱性物质。在适当条件下,它们相互之间有下图所所示的转化关系:
|
(1)用化学式表示化合物L 单质C 。
(2)物质Z的分子空间构型是 。
(3)反应①的化学方程式
________________ 。
(4)反应⑤的化学方程式
。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论纸值偏 (填
“高”或“低”),其原因是 。
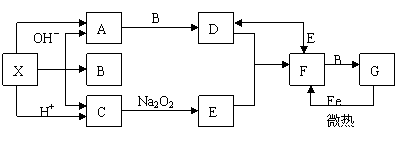
6.下图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均巳略出。
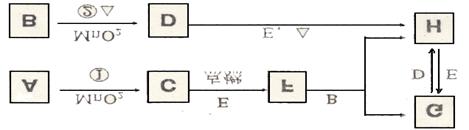
(1)写出化学式:B_____________、E_____________;
(2)指出MnO2在相关反应中的作用;反应①中是________剂,反应②中是_____剂。
(3)完成F与B发生反应的化学方程式______________________________________。
(4)若反应①是在加热条件下进行,A是_______;若反应①是在常温条件下进行,A是_________ 。若在上述两种条件下得到等量的C单质.反应中转移的电子数之比为__________。
7.已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
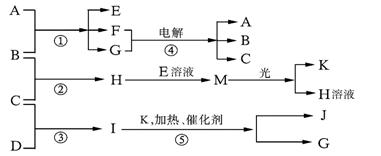
请填写下列空白:
(1)写出下列物质的化学式: 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
8.(17分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。
五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元 素原子个比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
(1)写出元素符合:B E
(2)A元素某原子核内中子数比质子数多1,则该核素的核组成符合为 。
物质丁的分子为 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是 。
(4)已知有机物乙的分子为平面结构,碳氢键间的夹角约为120°,实验室制取乙的化学方程式为 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为 。
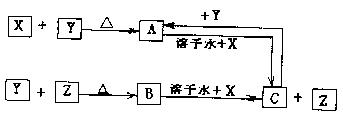
9.A、B、C是常见单质,X、Y、Z是氧化物,它们之间有如下转化关系:
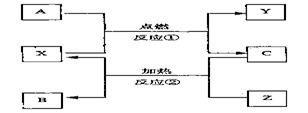
请写出符合下列要求的化学方程式:
(1)若X为CO2,则:
反应① ;
反应② 。
(2)若X为Fe3O4,则:
反应① ;
反应② 。
10.A、B、C、D、E、F是中学化学中常见的六种物质,它们之间有如下转化关系:其中B、D在通常情况下是气体物质,F溶液呈强碱性。
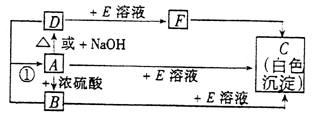
(1)写出C的化学式_____________。
(2)写出反应①的化学方程式________________________。
(3)配制F溶液时必须注意:①_____________;②____________;③ (“ ”有示有则填写,无则不填写)
(4)写出F与盐酸反应的离子方程式______________________。
11.A、B、C、D是四种人们熟悉的与生命运动密切相关的化合物,它们所含的元素不超过三种,并有下列关系(反应条件均未注明)
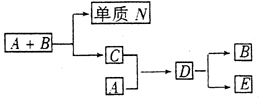
目前化合物B在自然界含量呈上升趋势,对环境产生了不利影响,E是一种生活中常见的化合物,在一定条件下可与单质N进一步发生如下变化:E+3N→3A+2B
(1)A、B、C、D分别是什么物质,常温下,A和B转化为C的途径是什么?
(2)假设在上述转化中无损耗,如有0.1molE生成,求A和B转化为C时能产生多少克单质N?
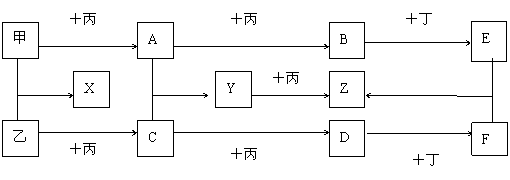 12.(6分) 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的摩尔质量比Z小16,乙与丙的摩尔质量相同,B的摩尔质量比D的小2,B与X的摩尔质量相同,各物质转化关系如下图(各反应条件已略去)。
12.(6分) 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的摩尔质量比Z小16,乙与丙的摩尔质量相同,B的摩尔质量比D的小2,B与X的摩尔质量相同,各物质转化关系如下图(各反应条件已略去)。
(1) 丙、B的分子式分别为 、 。
(2) Y转化为Z的化学方程式 。
(3) E与F反应的离子方程式 。
13、A、B、C、D、E、F、G七种常见物质,它们满足下图的转化关系:
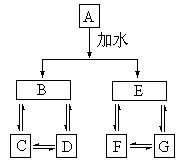
①A、B、C、D、E、F、G都不是氧化物
②D、G是钠盐
③A、B、C、D含同一种元素
④A、E、F、G含同一种元素,且F为单质,E在常温下为气体
请回答:
(1)写出A、F的化学式:A
、F
(2)写出下列反应的离子方程式:
①D®C
②C+D®B
14.(14分) 某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO![]() 、S2-、CO
、S2-、CO![]() 、SO
、SO![]() 、SO
、SO![]() ,现取该溶液进行有关实验,实验结果如下图所示:
,现取该溶液进行有关实验,实验结果如下图所示:
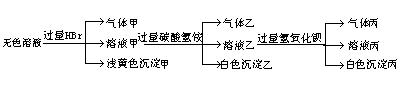
试回答下列问题:
(1) 沉淀甲是____________,
(2) 沉淀乙是__________,
(3) 由溶液甲生成沉淀乙的离子方程式为:_________________________。
(4) 气体甲成分可能有哪几种?(可以不填满也可以补充,多填要扣分)
| 1 | 2 | 3 | 4 | 5 | 6 |
(5)综合上述信息,可以肯定存在的离子:_____________________________。
15、(10分)一定条件下发生如图所示的转化关系,其中A、B、C为中学化学中常见元素的化合物,甲、乙、丙均为单质。
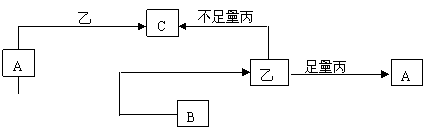
(1)若A是CO2,甲能在A中剧烈燃烧 ①化合物B的电子式为 ,
单质丙分子式 ;②现有下列药品和制气装置:实验药品:a.氯酸钾 b.大理石
c.过氧化钠 d.二氧化锰 e.甲酸 f.浓硫酸 g.稀硫酸 h.浓硝酸 i.双氧水 j蒸馏水
选择上述所给的一些药品,既可以制取CO2,又可以制取气体丙,制取CO2应选用的药品是 ,制取气体丙的化学反应方程式
(2)若A、B、C均为溶液,单质乙在常温下为液态,反应均在溶液中进行,写出A与甲按物质的量之比为1:1发生反应的离子方程式
。
16.(8分)A、B、C、D是中学化学中四种常见的非金属单质,在标准状况下,它们之中有三种呈气态,只有一种呈固态。B的相对分子质量很小。甲、乙、丙、X、Y五种物质都是化合物,这些化合物和A、B、C、D之间有如图所示关系:
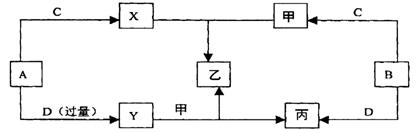
且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有 个化合反应, 个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为: 。
17.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
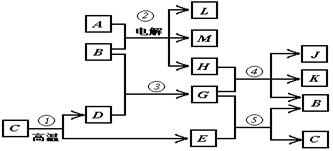
(1)单质L是_______________。
(2)化合物B是_____________。
(3)图中除反应①外,还有两个用于工业生产的反应是______和_______(填代号)
它们的化学反应方程式分别是____________________和____________________。
18、已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。
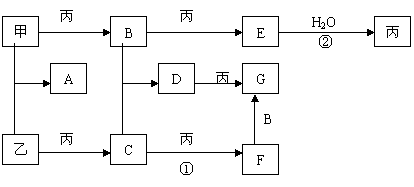 |
试回答:
(1)B的化学式是:______ ,D的名称是_________ ;
(2)用电子式表示A:
(3)写出①、②两步变化的化学方程式:
19.(13分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
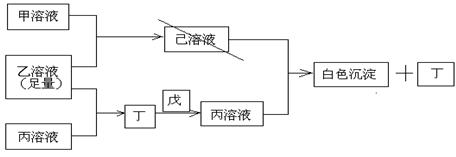
请回答:
(1)写出C元素的原子结构示意图_______________,写出丁和戊的电子式____________、_________________;
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________________________;
丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
20.X、Y、A、B、C、D是中学化学教材中常见的化合物,且有如下转化关系。气体C的式量比气体X的式量大2,产物中水已忽略。
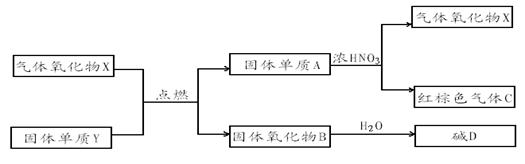
回答下列问题:
(1)X分子的电子式是______________________。
(2)在上述转化过程中作还原剂的物质有(填物质的化学式)___________________
(3)A与浓HNO3反应的化学方程式为_______________________________________
(4)测定气体C的相对分子质量,测得的数值与气体的相对分子质量有差异的原因是(用化学方程式表示)_____________________________________________________。
21.(10分) 三种常见单质甲、乙、丙,三种常见的化合物X、Y、Z,它们在一定条件下相互转化关系如下:
请填写以下空白:
(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的有:______________
(2)当X为两非金属元素所组成的化合物时,写出X跟丙反应的化学方程式________,X跟甲反应的化学方程式_________________________。
(3)当X为金属元素与非金属元素所组成的化合物时,写出X跟丙反应的化学方程式_____ ,X跟甲反应的化学方程式_____________________。
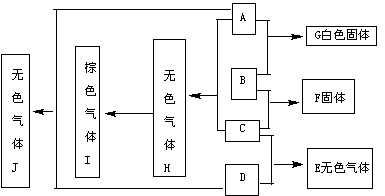
22.(9分)下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质
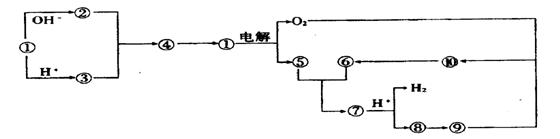
(1)①的化学式为 ,⑤和⑥反应的化学方程式为 。
(2)实验室由⑧制取⑨的离子方程式为 ,⑨转变为⑩的化学方程式为 。由⑨转变为⑩的反应现象为
参考答案:
1.(1)NH4HCO3 NH3 H2O
(2)2CO2+2Na2O2=2Na2CO3+O2↑
(3)排水 向上排空气
2.(8分)(1)X-Fe Y-Br2 Z-H2(各1分) (2)2Fe2++Br2=2Fe3++2Br(2分)
(2)不是(1分),因X是前四周期元素。且在A和C中显示不同正价。(2分)
3.(1)Mg(镁),H2(氢) (每空1分,共2分)
(2)3Mg+N2![]() Mg3N2(2分)
Mg3N2(2分)
(3)O2+2NO![]() 2NO2 (2分)
2NO2 (2分)
4. (1) HF、H2O、NH3、NO( 每空1分)
(2) 2F2 + 2 H2O ==4HF+ O2 4NH3+ 5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O
5.(14分,每空2分) (1)NO
H2 (2)三角锥型 (3)3Mg+N2 Mg3N2
![]() (4)4NH3+5O2
(4)4NH3+5O2
4NO+6H2O (5)高 NO2分子相互反应有N2O4生成(2NO2 N2O4)
6(1)HCl、Fe(2)催化 氧化) (3)Fe3O4 + 8HCl=FeCl2 +2FeCl3 +4H2O
(4)KClO3 H2O2 2:1
7.(1)B.Cl2 J.NO(2) ①H+
+ClO-= HClO (3)NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- (4)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1
NH4++OH- (4)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1
|
![]() (3)O2
4)CH3CH2OH CH2=CH2↑+H2O
(3)O2
4)CH3CH2OH CH2=CH2↑+H2O
(5)Al3++3HCO3—=Al(OH)3↓+3CO2
9.(1)、2Mg+CO2![]() 2MgO+C, C+2CuO
2MgO+C, C+2CuO![]() 2Cu+CO2
2Cu+CO2
(2)、3Fe3O4 +8Al![]() 9Fe+4Al2O3
3Fe+4H2O(气)
9Fe+4Al2O3
3Fe+4H2O(气)
![]() Fe3O4 +4H2
Fe3O4 +4H2
10.(1)AgCl (2)NH3+HCl=NH4Cl
(3)①防止氨水过量 ②随用随配
(4)[Ag(NH3)2]++Cl-+3H++OH-=AgCl↓+H2O+2NH![]()
11.(1)A∶H2O B∶CO2 C∶淀粉 D∶葡萄糖
6CO2+6H2O![]() C6H12O6+6O2,
C6H12O6+6O2,
(2)上式再结合C6H12O6 ![]() 2C2H5OH+2CO2,可得关系式:C2H5OH~3O2
2C2H5OH+2CO2,可得关系式:C2H5OH~3O2
故生成氧气的质量=0.1×3×32=9.6 (g)
12.(6分)(1)O2 Na2O2(每空1分,共2分)
(2) 2Na2SO4+O2=2Na2SO4(2分)
(3) H++OH-=H2O(2分)
13.(1)四;Ⅷ (2)???;![]() ;分子晶体;离子晶体 (3)
;分子晶体;离子晶体 (3)![]() ;
;![]() (4)16
(4)16
14. (1)甲 S (2)乙![]() 、
、![]()
(3)丙![]() ,可能BaSO4
,可能BaSO4
(4)
| H2S | SO2 | CO2 | H2S、CO2 | SO2、CO2 |
(5)![]() 、
、![]() 、
、![]() 、
、![]()
15、(10分)(1)① Mg2+ [ O ]2 - , O2
②,bhj,2Na2O2 + 2H2O = 4NaOH + O2↑
(2)2Cl2 + 2Fe2+ + 2Br- = 4Cl- + 2Fe3+ + Br2
16.(8分)
(1)H3PO4
(2)5;4 (3)PCl5+4H2O H3PO4+5HCl (每空2分)
17.(8分)
![]() (1)H2 (2)H2O (3)②,④ 2NaCl+2H2O
,2Ca(OH)2+2Cl2=
(1)H2 (2)H2O (3)②,④ 2NaCl+2H2O
,2Ca(OH)2+2Cl2=
25 (1) Na2O ,D 亚硫酸钠 ;(2)
(3) ① 2SO2+O2=2SO3 ,② 2Na2O2+2H2O=4NaOH+O2;。
19.答案:(1)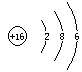 ;
; ;
; ;
;
(2)NaHSO4=Na++H++SO42-;CO32-+H2O HCO3-+OH-
(3)2H++CO32-=H2O+CO2↑;
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
20.(1)略 (2)Mg C
(3)C+4HNO3===CO2+4NO2+2H2O
![]() (4)2NO2
N2O4
(4)2NO2
N2O4
21.(10分,每空2分)
⑴X,Z ⑵ CO2 + C ![]() 2CO;CO2 + 2Mg
2CO;CO2 + 2Mg ![]() 2MgO + C
2MgO + C
⑶ 2FeBr2 + Br2 == 2FeBr3;2FeBr2 + 3Cl2 == 2FeCl3 + 2Br2