高三年级化学调研考试考前练习
化 学 试 卷
第I卷(选择题 共42分)
可能用到的原子量:
H 1 C 12 O 16 Na 23 S 32 Cl 35.5 K 39 Cu 64 I 127
选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1.下列现象的产生与人为排放大气污染物氮氧化物无关的是
A.闪电 B.光化学烟雾 C.酸雨 D.臭氧层空洞
2.下列除去杂质的方法正确的是
A.乙烷气体中混有少量乙烯:通入氢气,使乙烯发生加成反应
B.二氧化碳气体中混有少量二氧化硫:通入饱和碳酸氢钠溶液后,收集气体
C.乙醇中混有少量乙酸:加入氢氧化钠溶液后,分液
D.氯化钠溶液中混有少量硫酸钠:加适量硝酸钡溶液,过滤
3.通过核裂变产生核能而用于发电的核燃料是235 U,下列说法错误的是
A.U元素的相对原子质量为235 B.235 U中中子数比质量子数多51
C.235 U与12C的质量比约为235∶12 D.235 U与238 U互为同位素
4.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是
A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m
5.在一密闭容器中,反应aA(g)=bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来65%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
6.下列各组中,两种气体的分子数相等的是
①温度相同、体积相同的O2和N2 ②质量相等、密度不等的N2和C2H4
③体积相等、密度相等的CO和C2H4 ④压强相同、体积相同的N2和O2
A.①② B.②③ C.③④ D.①④
7.工业上常用水吸收HCl气体制盐酸。经测定某盐酸的物质的量浓度为12.0mol/L,密度为1.19g/cm3,则用于吸收形成100mL此盐酸的水的体积是
A.75.2mL B.85.5mL C.90.8mL D.100mL
8.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量CO2 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O
C.用氨水吸收少量SO2 NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
9.将等物质的量的镁和铝相混合,取四份等质量的混合物分别加到足量的下列溶液中,分反应后,放出氢气最多的是
A.3mol/L HCl B.4mol/L HNO3
C.8mol/L NaOH D.18mol/L H2SO4
10.为了鉴别硫酸溶液和水,设计了5种方案:
①用量筒量取相同体积的两种液体,分别置于两只相同的烧杯中,置于托盘天平两托盘上,质量较大者为硫酸溶液
②取样,分别加入无色酚酞试液,能使酚酞变色的是硫酸溶液
③以电导装置分别测试它们的导电性,导电能力强的是硫酸溶液
④在两种液体的试样中,分别加入少量铁粉,铁粉溶解且生成浅绿色溶液的是硫酸溶液
⑤取两块完全相同的小木块,分别置于两种液体中,露出体积大者是硫酸溶液
你认为上述方案中不合理的是
A.只有② B.只有①② C.只有②③④ D.全部
11.有Na2CO3、AgNO3、BaCl2、HCl、NH4NO3 5瓶无标签的溶液,为鉴别它们,取4支试管分别装入一种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列表达中
错误的是
A.若3支试管出现沉淀时,则后加入的是AgNO3溶液
B.若全部没有什么现象变化时,后加的是NH4NO3溶液
C.若1支试管出现气体,2支试管出现沉淀时,最后加入的是HCl溶液
D.若只有2支试管出现沉淀其他试管均无明显现象时,则后加的是BaCl2溶液
12.下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③ B.②④ C.③⑥ D.⑤⑥
13.常温时A物质的溶解度为15g,B物质的饱和溶液的质量分数为15%,而浓度为15%的C物质溶液100g,蒸发掉15g水,恢复到常温时析出晶体1g,则此三种物质在常温时的溶解度SA、SB、SC由大到小的顺序正确的是
A.SA>SB>SC B.SC>SB>SA C.SC>SA>SB D.SC=SB>SA
|
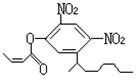
14.阿乐丹的结构简式可简写为 ,它在稀酸作用下能水解生成两
种有机物,这两种有机物可能共同具有的性质是
①均能与NaOH溶液反应; ②遇FeCl3溶液均显紫色;
③一定条件下均能与氢气发生加成反应; ④均能与溴水发生加成反应
A.①③ B.②④ C.①④ D.②③
高三年级调研考试考前练习
化 学 试 卷
| 题号 | 选择题 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 总分 |
| 分数 |
请将选择题答案填入下表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 答案 |
第II卷(非选择题 共58分)
15.(8分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉沉乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是 。
(2)一定存在的离子是 。
(3)判断沉淀乙成份的方法是 。
16.(10分)某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水,瓶丙浓硫酸,分液漏斗A中盛浓盐酸。
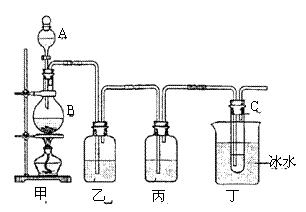
回答:
(1)烧瓶B中盛 ,大试管C中盛 。
(2)C中发生反应的化学方程式 。
(3)有同学认为可以省去某些装置,你认为怎样?
①能否省去乙装置 (答“能”或“不能”),理由是 ;
②能否省去丙装置 (答“能”或“不能”),理由是
。
17.(10分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;E与A同主族;A、B、C这三种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出下列元素的元素符号:A ,E 。
(2)D在周期表中位于第 周期,第 纵行。
(3)B的最高价氧化物的电子式为 。
(4)E和D形成的化合物与水反应的化学方程式为 。
(5)盐X的水溶液显 (填酸、碱或中)性,其原因用离子方程式表示是:
。
18.(8分)如图所示
|
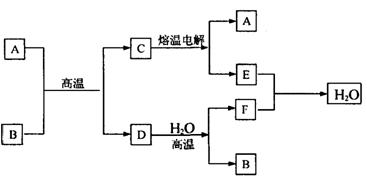
已知A、D、E、F是中学化学中的常见单质,B、C是氧化物,且B的式量是232。请填空:
(1)A是 ,E是 。(填化学式)
(2)D跟水反应的化学方程式是 。
(3)C电解时,每生成1molA同时生成 molE。
(4)先将B溶于足量盐酸,再在用盐酸溶解后的溶液中通人足量Cl2,请写出全过程中有关反应的离子方程式: 。
19.(7分)有甲、乙两份等体积的浓度均为![]() 的氨水,pH为11.
的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则![]() 的电离平衡将向________(填“促进”或“抑制”)电离的方向移动,溶液的pH将为________(填序号).
的电离平衡将向________(填“促进”或“抑制”)电离的方向移动,溶液的pH将为________(填序号).
A.9~10之间 B.11 C.12~13之间 D.13
(2)乙用![]() 的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是
的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是
.
20.(9分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如图所示,B和D互为同分异构体。
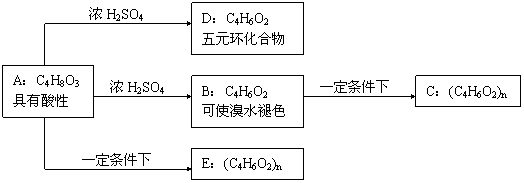 |
试写出:
(1)化学方程式:A→D: ;B→C: ;
(2)反应类型:A→B ;
A→E: ;
(3)E的结构简式为 ;写出A的同分异构体(同类别且有碳支链)的结构简式 和
21.(6分)在碘量瓶(一种专用锥形瓶)中加入5.00mL的NaClO漂白液(密度为1.00g·mL-1),再加入过量的KI溶液。然后,加入适量稀H2SO4,立即以淀粉溶液为指示剂,用0.100mol·L-1Na2S2O3溶液滴定,到达终点时消耗Na2S2O3溶液33.8mL。(已知I2+2Na2S2O3=2NaI+Na2S4O6)
(1)写出NaClO与KI反应的离子方程式: 。
(2)计算漂白液中NaClO的质量分数w(NaClO)。
化学参考答案
1.A 2.B 3.A 4.D 5.C 6.B 7.A 8.D 9.A 10.A 11.C 12.C 13.B 14.A
15.(共8分)(1)Ag+、Ba2+、Al3+、MnO4-(3分)(多1、少1均扣1分,扣完为止)
(2)Na+、AlO2-、CO32-(3分)(同(1))(3)加入盐酸,观察沉淀是否全部溶解(2分)
16.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)
②能(1分),少量水蒸气进入C中,不影响反应(2分)(共3分)
|
(2)2,16 (各1分,共2分) (3) (1分)
(4)Na2O+H2O====2NaOH(1分),2Na2O2+2H2O====4NaOH+O2↑(1分)(共2分)
![]() (5)酸(1分),NH4++H2O NH3·H2O+H+(2分) (共3分)
(5)酸(1分),NH4++H2O NH3·H2O+H+(2分) (共3分)
18. (1)A、Al E、O2
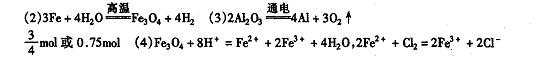 19.(1)促进,A (2)甲大
19.(1)促进,A (2)甲大
乙用氯化铵溶液稀释后,[![]() ]增大很多,使
]增大很多,使![]() 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动;![]() 发生水解,使稀释后的乙溶液的[
发生水解,使稀释后的乙溶液的[![]() ]增大
]增大
![]() 20.(9分)
20.(9分)
(1)HOCH2CH2CH2COOH CH2—C +H2O;
![]() nCH2=CH—CH2COOH
[ CH2—CH ]n
nCH2=CH—CH2COOH
[ CH2—CH ]n
(2)消去反应;缩聚反应;
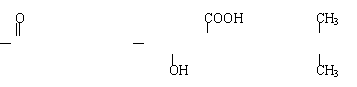 |
(3) [ C—CH2CH2CH2—O ]n ;CH2—CH—CH3 ;HO—C—COOH
21.(6分)(1)ClO-+2I-+2H+=Cl-+I2+H2O(2分)
(2)NaClO~I2~2Na2S2O3
74.5g 2mol
m(NaClO) 0.100×33.8×10-3mol
![]() (2分)
(2分)
![]() (2分)
(2分)