高三化学阶段性考试
化 学 试 题
命题:赵荣进
本卷考试满分150分。考试时间120分钟
可能用到的原子量:Cu-64 S-32 O-16 H-1 N-14
一、选择题(每小题只有一个正确答案,每题3分,共48分)
1、下列反应一定属于非氧化还原反应的是:
A、化合反应 B、分解反应 C、置换反应 D、 复分解反应
2、下列反应不属于置换反应的是:
A、甲烷和氯气见光 B、铝和三氧化二铁反应
C、镁在二氧化碳中燃烧 D、氯水中滴入碘化钾溶液
3、用特殊方法把固体物质加工到纳米级(1——100nm,![]() )的超细粉末粒子,然后制得纳米材料,下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是
)的超细粉末粒子,然后制得纳米材料,下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是
A、溶液 B、悬浊液 C、胶体 D、乳浊液
4、接触法制硫酸中的主要反应是2SO2+O2 ![]() 2SO3,该反应是一个放热反应。要提高二氧化硫的转化率,工业上采取的方法是:
2SO3,该反应是一个放热反应。要提高二氧化硫的转化率,工业上采取的方法是:
A、使用V2O5 做催化剂 B、通入足量的空气
C、降低温度到300℃ D、控制SO2 和O2的物质的量比为2:1
5、下列物质不属于我国城市“空气质量报告”所涉及到的大气污染物是:
A、二氧化硫 B 、二氧化碳
C、 氮的氧化物 D、悬浮颗粒
6、等物质的量浓度的下列溶液,NH4+浓度最小的是:
A、NH4Cl B、NH4HSO4 C、NH4NO3 D、 NH4F
7、用石墨作电极电解CuCl2、NaCl的混合溶液,在开始时阴、阳两极上分别析出的物质分别是:
A、 氢气、氯气 B 铜、氯气 C 氢气、氧气 D 铜、氧气
![]() 8、某烃的结构如下:
8、某烃的结构如下:
则该有机物的名称是:
A、2,3-二乙基丁烷 B 、3-甲基-2-乙基戊烷
C、2-甲基-3-乙基戊烷 C、3,4-二甲基己烷
9、某温度下,100克水中分别加入m克Cu SO4 和n克 Cu SO4·5H2O,均使溶液达到饱和,则m、n的关系是:
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
10、在4FeS2 + 11O2 = 8SO2 + 2Fe2O3 反应中,反应物中被氧化的元素为:
A、铁 B、硫 C、硫和铁 D、氧和铁
11、在下列过程中,必须加入氧化剂 才能实现的是:
A、KMnO4 → O2 B 、NaCl →Cl2
C 、 NH3 → NO D、 Na2O2 → O2
12、下列离子方程式书写正确的是
A、金属铝溶于过量的氢氧化钠溶液中:Al + 2OH-=AlO2- +H2↑
B、硝酸铝溶液溶于过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C、硫酸铁酸性溶液中通入足量的硫化氢: 2Fe3++H2S=2Fe2++S↓+2H+
D、次氯酸钙溶液中通入足量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
13、pH=2的某溶液中含有大量的 Fe2+、Fe3+、Mg2+、NH4+,则此溶液中还可以大量存在的离子可能有:
A、SO42- B、CO32- C、NO3- D 、SCN-
14、下列物质中属于纯净物的一组是
A、重水、液氯、氨水 B、冰水、液氨、次氯酸钙
C、聚乙烯、油脂、纤维素 D、五水硫酸铜、氢氧化铁胶体、红磷
15、某温度下,将CO2和CO按3:1的比例混合后,充入一体积不变的容器中,测得压强为P,然后投入足量的过氧化钠,在电火花作用下充分反应至完全,恢复到原来的温度,如不计固体物质的体积,容器中的压强为:
A、P
B、![]() P
C、
P
C、![]() P
D、
P
D、![]() P
P
16、有X、Y、Z三种元素,X元素的一种核素失去电子后变成质子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素和Y元素位于同一周期,Z2- 和同周期稀有气体的原子的电子层结构相同,则由X、Y、Z三种元素组成的分子式不可以是:
A、X 2Y Z3 B、X 2Y 2 Z4 C、X 3Y Z4 D、X 2Y2 Z3
二、选择题(每小题有一个或两个正确答案,每题4分,共32分)
17、不能使溴水褪色褪色的物质是:
A、硬脂酸 B、丙烯酸 C、氢氧化钠溶液 D、亚硫酸钠溶液
18、可用水来加以区别的一组物质是
A、碳酸钙、碳酸钠、无水硫酸铜 B、苯、甲苯、对- 二甲苯
C、乙酸、乙醛、乙醇 D、碳化钙、碳酸钙、氧化钙
19、下列各组溶液由于相互加入的顺序不同,而观察到的实验现象不同的是:
A、硫氰化钾 和三氯化铁 B、三氯化铝和浓氨水
C、碳酸氢钠和澄清石灰水 D、稀硝酸银和稀氨水
20、将分别盛有熔化状态下的NaCl、MgCl2、Al2O3的电解槽,串联起来,用惰性电极进行电解,一端时间后,析出Na、Mg、Al的物质的量比是:
A、1:2:3 B 、1:1:1 C、6:3:2 D、 3:2:1
21、下列各组物质中,构成的微粒都是分子的是:
A、 干冰、食盐、二氧化硅 B 、冰醋酸、过氧化氢、甲醇
C、 氨气、盐酸、二氧化氮 D、 足球烯(C60)、臭氧、氢气
22、在一定的温度下,用石墨作电极电解饱和Na2CO3溶液,下列判断正确的是:
A、会有晶体析出 B、Na2CO3溶液的浓度会变大
C、溶液的pH值会变大 D、 溶液的质量会减小
23、在一接近中性的含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种,(1)在原溶液中滴加足量的饱和氯水后,有气泡产生;溶液呈橙黄色;(2)向呈橙黄色溶液中加入氯化钡溶液时,无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝色。根据上述实验事实推断,该溶液中不存在的离子是:
A、NH4+、Br-、CO32- B、Fe2+、I-、SO32-
C、NH4+、Br-、SO32- D、Fe2+、I-、CO32-
24、已知:3Br2+6FeCl2=4FeCl3+2FeBr3,则112mL Cl2(标准状况)通入10mL 1 mol/L的FeBr2液中,发生反应的离子方程式书写正确的是
A、Cl2+2Br-=2Cl-+Br2 B、Cl2+2Fe2+=2Cl-+2Fe3+
C、2Fe2++2Br-+2Cl2=2Fe2++Br2+4Cl- D、2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
三、填空题:
25、(本题5分)我国工业上制硫酸的主要含硫原料是(写名称和化学式) (理论上还可以有其它含硫原料),所需的设备为 、 。由于水和三氧化硫反应放出大量的热使水汽化而形成酸雾不利于三氧化硫的吸收,因此用浓度为 的浓硫酸吸收。
26、(本题8分)有一黑色固体A,加入稀盐酸后,发生反应生成无色有臭鸡蛋气味的气体B ,点燃B后生成气体C,C遇B可生成淡黄色固体D.将A与盐酸反应后所得的溶液过滤,向滤液中滴入苛性钠溶液,先生成白色沉淀,沉淀在空气中很快变为灰绿色,并逐渐变为红褐色.根据以上现象回答:
(1)用化学式表示A__________、B____________、C_________、D________;
(2)写出 下列化学方程式:
滤液滴入苛性钠溶液生成白色沉淀 __
白色沉淀变为红褐色__ __
27、(本题8分)短周期元素X、Y、Z在元素周期表中的位置如下图所示:
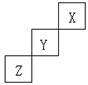 则(1)X元素单质的分子式为__________如X核内的质子和中子数相等,X单质的摩尔质量为__________
则(1)X元素单质的分子式为__________如X核内的质子和中子数相等,X单质的摩尔质量为__________
(2)Y单质的电子式为_________,Y的单质和水反应的化学方程式是
(3)Z和钠可组成化合物Na2Zx和过氧化氢溶液反应产生淡黄色的沉淀,写出反应方程式为___________________
28、(本题7分)水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2、CO2和水蒸气。请用下列装置设计一个实验,以确认混合气中含有CO和H2。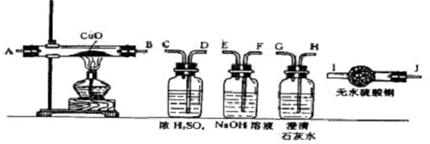
(1)连接上述装置的正确顺序是:(填各接口的代码字母)
混合气→( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )。
(2)确认混合气中含有H2的实验现象是:____________________________;其理由是________________________________________________________________________
29、(本题7分)配平下列反应方程式,并标出电子转移的方向和数目。
(1)( )![]() ( )
( )![]() ( )
( ) ![]() ( )
( )![]()
(2)如氨气和二氧化氮共1.5mol,且氧化产物比还原产物的质量多2.8克, 则:二氧化氮物质的量为__________或__________.
30、(本题8分)氯化银、氢氧化银都能和氨水反应生成Ag(NH3)2+,Ag(NH3)2+能和H+反应:Ag(NH3)2+ + 2H+= Ag+ + 2NH4+,今有一白色固体可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的两种或三种组成的,为了确定该白色固体的成分,进行以下实验:(1)取白色固体少许,加入适量蒸馏水,充分振荡得无色溶液;(2)取(1)得到的溶液少许,滴加适量的硝酸,有白色沉淀生成。则此白色固体必须含有的物质可能有两种组合:
第一种是NH4Cl 、____________________________。
第二种是 __________________________________。
在第一种情况下加入足量的稀硝酸时仍有白色沉淀,该白色沉淀是___________。
在第二种情况下加入稀硝酸时也产生白色沉淀,其离子方程式为 _______________。
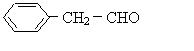
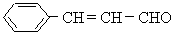 31、(本题14分)有机物甲的结构为:
31、(本题14分)有机物甲的结构为:
有机物乙的结构为:
则:(1)甲的分子式为______________,1mol 甲最多可和氢气_________ mol反应。它还可以和下列物质中的____________反应
A 溴水 B新制的氢氧化铜 C高锰酸钾溶液 D银氨溶液 E碳酸氢钠溶液
(2)有机物乙的一种同分异构体能和氯化铁溶液反应,且显紫色。则该同分异构体属于______类。若该异构体的苯环上只有两个取代基,且处于相对的位置,则其结构为:
_______________________________________。
(3)有机物乙的氧化产物和还原产物在浓硫酸的作用下能发生________ 反应,反应的化学方程式为____________________________________。
| 班级______________学号______________姓名_________________年级考试总号_______________ 密封线内不得答题 ………………………………………………………密…………………………封…………………………线……………………………………………… |
高三阶段性考试
化 学 答 卷
2002.8.29
命题:赵荣进
本卷考试满分150分。考试时间120分钟
| 题 号 | 一 | 二 | 三 | 四 | 总 分 |
| 得 分 |
一、选择题(每小题只有一个正确答案,每题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、选择题(每小题有一个或两个正确答案,每题4分,共32分)
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 |
四、填空题:
25、(本题5分)_________, , , _________, 。
26、(本题8分)
(1)用化学式表示A__________、B____________、C_________、D________;
(2)写出 下列化学方程式:
滤液滴入苛性钠溶液生成白色沉淀 __
白色沉淀变为红褐色__ __
27、(本题8分)(1)为_________________________为_____________________
(2)为___________, ________
(3) _______ _________________________
28、(本题7分)
(1)连接上述装置的正确顺序是:(填各接口的代码字母)
混合气→( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )。
(2)确认混合气中含有H2的实验现象是:____________________________;其理由是________________________________________________________________________
29、(本题7分)
(1)( )![]() ( )
( )![]() ( )
( ) ![]() ( )
( )![]()
(2)二氧化氮物质的量为__________或__________.
30、(本题8分)
第一种是NH4Cl 、____________________________。
第二种是 __________________________________。
在第一种情况下加入稀硝酸时产生的白色沉淀是______________________。
在第二种情况下加入稀硝酸时产生白色沉淀,其离子方程式____________________。
31、(本题14分)
(1)______________, _________ mol。____________
A 溴水 B新制的氢氧化铜 C高锰酸钾溶液 D银氨溶液 E碳酸氢钠溶液
(2)______类。 其结构为:_______________________________________。
(3)________ 反应,反应的化学方程式为
_____________________________________________。
四、计算题
32、(本题7分)把含(NH4)2SO4和NH4NO3的混合物分成两等份,一份需用b mol烧碱刚好把NH3全部赶出;另一份与BaCl2溶液完全反应时消耗c molBaCl2.由此可知:
① 原混合物中(NH4)2SO4多少摩尔?
② 混合物中氮元素的酚含量为多少?
33、(本题6分)已知 Cl2+2NaOH=NaCl+NaClO+H2O ; 3Cl2+6NaOH=5NaCl+NaClO3+3H2O
现将氯气通入NaOH溶液中,生成的ClO-与ClO3-之比为1:3求:反应中氯原子被氧化和被还原的数目之比为多少?