高三化学练习化学实验(2)
可能用到的原子量:H:1 C:12 N:14 O:16 Cl:35.5 Na:23 Mg:24
第I卷(72分)
一、选择题(本题8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.下列盛放物质的方法:①把汽油放在带橡皮塞的玻璃试剂中 ②把氢氧化钠溶液放在带橡皮塞的试剂瓶中 ③把硝酸放在棕色的玻璃试剂瓶中 ④把氢氟酸放在无色透明的玻璃试剂并瓶中 ⑤把白磷放在水中,其中正确的是 ( )
A.①②③④⑤ B.②③⑤ C.①④ D.①②③
2.下列试纸使用下,不宜先用水润湿的是 ( )
A.红色石蕊试纸 B.PH试纸 C.蓝色石蕊试纸 D.淀粉碘化钾试剂
3.除去下列气体中的有关杂质(括号内为杂质),选用的试剂最好的是 ( )
A.SO2、(SO3气体),用Na2SO3饱和溶液和P2O5
B.C3H6(C2H4),用溴水和碱石灰
C.H2S(H2O蒸气),用浓硫酸
D.NO(NO2),用烧碱溶液和浓硫酸
4.用98%的浓硫酸(密度为1.84g/cm3)配制1 mol/L的稀H2SO4100mL。配制过程中可能用到下列仪器:①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容置瓶 ⑥胶头滴管 ⑦玻璃棒。按使用先后顺序排列正确的是 ( )
A.④③⑦⑤⑥ B.②⑤⑦④⑥
C.④③⑤⑦⑥ D.②⑥③⑦⑤⑥
5.下列实验过程中无明显现象的是 ( )
|
B.氨气通入AlCl3溶液中
C.CO2气体通入CaCl2溶液中
D.MgCl2溶液滴入肥皂水中
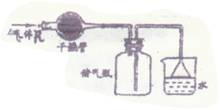
6.在实验室里按图所示的装置来干燥、收集气体R,
多余的气体可用水来吸收,则R是 ( )
A.HCl B.Cl2 C.NO2 D.NH3
7.将0.5升0.1摩/升的NaOH溶液跟0.5升0.08摩/升的盐酸混合后,将混合后溶液分成3份,并分别滴入石蕊,甲基橙和酚酞3种试剂,则混合液将呈现的颜色是 ( )
A.红、橙、蓝 B.蓝、黄、红 C.红、蓝、无 D.蓝、橙、红
8.下列各组无色溶液,只需用试管和胶头滴管,不用其他任何试剂就可以鉴别的是:①KOH,Al2(SO4)3,MgCl2 ②Ba(OH)2,NaHCO3, 稀H2SO4 ③稀盐酸,NaAlO2,NaHSO4 ④石灰水,Na2CO3,BaCl2
A.只有① B.只有①② C.只有②③ D.①②④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项时,多选时,该题为0分,若正确答案包括两个选项,只选一个正确的给2分,选两个且都正确的给4分,但只要选错一个该小题就为0分)
9.下列各组物质可能分液漏斗分离的正确的组合是 ( )
①乙醇和乙酸 ②葡萄糖溶液和蔗糖溶液 ③苯和食盐水 ④苯和苯酚 ⑤乙酸乙酯和乙醇 ⑥甲酸乙酯和纯碱溶液
A.③⑥ B.①③④⑥ C.①②④⑥ D.③⑤⑥
10.确证某溶液中含CO2— 3 的正确方案是 ( )
A.加AgNO3溶液产生白色沉淀 B.加稀HCl产生无色无味的气体
C.加稀盐酸产生的气体不使品红溶液褪色,但能使石灰水变浑浊
D.加BaCl2产生白色沉淀,再加盐酸现象与(C)相同
11.下列各组物质分离的方法正确的是 ( )
A.苯和苯酚用液的方法 B.NaCl与KNO3用分步结晶的方法
C.碘与NH4Cl用加热升华的方法 D.淀粉糊中含有NaCl用渗析的方法
12.120℃、101.3Pa条件下,有等体积的H2O、H2、CO、O2、CO2组成的混合气体,将混合气体通过放有足量Cu粉、C粉、CuO粉的三个反应管,最后得到二种气体组成的混合气体,若其中一种是H2O,则另一种气体是 ( )
A.H2 B.CO C.O2 D.CO2
13.下列实验的失败是因为缺少必需的实验步骤造成的是 ( )
①锌与稀H2SO4反应制取氢气,用排气法收集不到氢气
②实验室用无水乙醇和浓H2SO4共热140℃,制乙烯时得不到乙烯
③验证RX是碘代烷,把RX与NaOH水溶液混合后,加入AgNO3溶液出现褐色沉淀
④做醛的还原性实验时,当加入新制的Cu(OH)2悬浊液后,未出现红色沉淀
⑤检验淀粉已水解,将淀粉与少量稀H2SO4加热一段时间后,加入银氨溶液后未出银境
A.①②③④⑤ B.①③④⑤ C.③④⑤ D.②⑤
14.下列实验操作中,仪器需插入液面下的有 ( )
①制备Fe(OH)2用胶头滴管将NaOH溶液滴入FeSO4溶液中
②用于制备H2的简易装置中的长颈漏斗 ③石油分馏时控制温度所用的温度计
④用乙醇制备乙烯时所用的温度计 ⑤用水吸收NH3时的导气管 ⑥向试管中的BaCl2溶液中滴加稀H2SO4
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④
15.为了除去酸性氯化铝溶液中的Cu2+,下列实验步骤顺序和试剂正确的是 ( )
①通CO2气体 ②加盐酸 ③加过量NaOH溶液 ④加AlCl3 ⑤过滤
A.③⑤④⑤② B.③⑤②
C.③⑤①② D.③⑤①②
16.用已知浓度标准盐酸滴定未知浓度NaOH溶液,会导致待测碱液浓度的实验结果偏低的操作是 ( )
A.酸式滴定管用蒸馏水洗后用标准盐酸润洗
B.锥形瓶用蒸馏水洗后再用待测碱液润洗
C.用移液管称取NaOH溶液之前用蒸馏水洗后未用NaOH溶液润洗
D.读标准盐酸体积时,开始时仰视读数,结束时俯视读数
17.某同学在设计实验中使用了以下数据:①用托盘天平称取无水Na2CO35.2g ②用量筒取浓盐酸6.34毫升 ③用广泛PH试纸测得的PH值为7.8 ④用盐酸滴定Na2CO3溶液用去盐酸11.20毫升,其中数据不合理的是 ( )
A.①③ B.①④ C.②③ D.②④
18.分离蛋白质的实验方案中需要一种试剂,它既能改变蛋白质的溶解性又不破坏其活性。该试剂是 ( )
A.硫酸汞 B.硫酸铵 C.硫酸 D.烧碱
第II卷(78分)
三、填空题(2小题,共22分)
19.(8分)①现有Ba2+、Mg2+、Al3+、Ag+的混合液,每次用过量的试剂将它们一一沉淀加以分离。依次加入的常用酸碱试剂是(与分子式)(1) (2) (3)
(4)
②(4分)有三瓶无标签溶液,已知它们分别是HCl、H2SO4和H3PO4试用最少种类的试剂,最简捷的方法鉴别它们:试剂是: ,操作步骤和现象:
20.(14分)
①(4分)选用下列试剂,甲基橙溶液,酚酞溶液,稀醋酸,稀盐酸,醋酸钠晶体,烧碱,蒸馏水等设计两种方法,证明醛酸是一种弱电解质。
方法1:
方法2:
②(10分)工厂的工业废水,不可直接往江河排放,否则造成严重公害。某河道两旁有甲、乙两厂,它们排入的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl—、SO2— 4 、NO— 3 、OH—的四种。又知甲厂排放污水pH>7。
(1)甲厂污水中含有的4种离子可能是:
(2)乙厂污水中含有的4种离子可能是:
(3)工厂进行废水处理,方法之一,可往废水加入一定量 (选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属 (填元素序号)
(4)工厂的另一种重要措施是将甲、乙两厂废水按适当比例混合,可使废水中的: (填离子符号)转化为沉淀 ,再排放则大大降低污染程度。过滤所得废水中主要含 可用于浇灌浓田。
四、(每小题,共18分)
21.(8分)一种澄清透明的溶液中,可能含有下列离子:Ba2+、Fe3+、Al3+、NH+ 4 、Cl_、NO— 3 、HCO— 3 、SO2—4 ,现做以下实验:(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;(2)取少量溶液;加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;③将(2)中的沉淀过滤,向滤液中中入AgNO3溶液,产生白色沉淀;(4)另取溶液再逐渐再滴加入NaOH溶液至过量,只观察到有红褐沉淀生成,且沉淀质量不断减少,由此可以断定:
溶液中肯定存在的离子是 溶液中肯定不存在的离子是
溶液中不能确定是否存在的离子是
22.(10分)有A、B两种溶液,将它们以等物质的量浓度、等体积混和,产生了白色沉淀C和无色气体D。过滤后得溶液E。C既不溶于盐酸也不溶于于氢氧化钠溶液,D通入石灰水时有白色沉淀。在溶液E中加入盐酸又产生气体D,而加入氢氧化钠溶液则能产生酚酞变红的气体F,又测得A溶液显强酸性,B溶液显弱碱性,且在B溶液中通入F气体会产生白色沉淀。根据以上叙述判断:D是 F是 ;A可能是 B可能是 。与写溶液E与足量氢氧化钠溶液反应的离子方程式 。
五、(2小题,共23分)
23.(8分)已知过氧碳酸钠(Na2CO4)和盐酸反应的化学方程式为:
|
商品过氧碳酸钠中往往含有
少量的碳酸钠。为测定其纯度
,现称取0.90g样品进行实验。
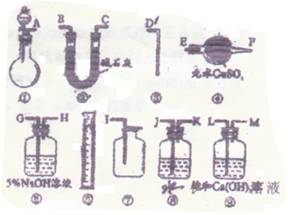
供选用的仪器、试剂如右图所
示。
(1)为了使实验尽可能简单,
应选用的装置是(填编号) 。
(2)所选用的装置的连接顺序是(填字母) 。
(3)若所测定的O2质量为mg,则样品的纯度为 。
(4)实验室有50mL,100mL,500mL三种规格的量筒,实验时用的量筒的规格为
。
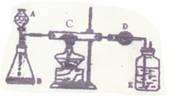
24(15分)某同学加热炭粉(过量)和氧化铜和混合物,并用如图所示的装置对获得的铜粉(含炭)样品进行实验测定,请完全实验报告。(一)实验目的: 。
(二)实验用品:仪器:天平,分液漏斗,锥瓶,硬质玻璃管,干燥管,酒精灯,洗气瓶等。
(三)实验步骤:
(1)
|
称得质量为m,选择仪器安装后,检查气密性。
(2) 打开A的活塞,慢慢滴加溶液,在B中进行
的化学反应方程为:
(3)C进行加热,当C中药品充分反应后,关闭A的活塞,停止加热,C中发生反应的方程式为 。
(4)冷却后,称量D的质量为m2;
(四)计算:实验时,C中反应完全,D中吸收完全,根据所得数据,样品中铜的质量分数
= (用含W,m1,m2的代数式表示)。
(五)问题讨论:
(1)E中盛试剂为 ,其作用是 。
(2)根据上述实验方案测得的铜的质量分数,跟实际的质量分数相比,是偏高、偏低、是相等? ,原因是 。
(3)如需要对同学设计的实验装置进行改进,请提出改进的方案是
。
六、(2小题,15分)
25(6分)用甲醇处理含有氨的废水,在某种细菌中作用下,发生如下反应:
|
|
(1)方程式①配平后的系数分别为: 。
(2)对某废水处理时,氨有95%转化为硝酸,硝酸有84%转化为氮气。若废水中含NH3 34mg·L—1,处理这样的废水500m3(密度以1g·cm—1计算),计算需甲醇的质量(kg)和放出氮气的体积(L)。
26.(9分)计算以下两小题时,除必须应用所给的数据外,还各缺少一个数据,指出该数据的名称和符号(包括单位),并列出计算式。
(1)在温度为t℃时和压强为ρ Pa的情况下,19.5gA与11.0gB恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。
缺少的数据是:
计算式为m=
(2)已知:M(Mg)=24g·mol—1,Vm=22.4L·mol—1,今有0.48g金属镁与10mL的盐酸反应,计算生成的H2在标态的体积(VH2)。缺少的数据:
计算式为:
![]() 单元十三化学实验
单元十三化学实验
一、1.B 2.B 3.B Na2SO3与SO2、H2O反应生成NaHSO3,损耗SO2,应用饱和NaHSO3溶液除SO3,H2S与浓H2SO4发生氧化一还原反应,生成新杂质SO2,NO、NO2同时与NaOH溶液反应,损耗NO,加水法才是好方法,既除NO2,又增加了NO,C2H4与溴水中溴加成,C2H6通过溴水中带出的水蒸气,被碱石灰吸收,选B。4.D 5.C 6.D 7.B 8.B
二、9.A 10.D 11.BD 12.D Cu只反应掉O2,C既反应掉H2O(g)生成H2、CO,又可反应掉生成,CuO既反样H2,生成H2O,又反应掉CO生成CO2。可以简便地考虑,三种除气固体分别放在最后位置:Cu或CuO在最后,得到气体均为CO2、H2O,C在最后,得到气体是CO、H2,均不可能得到单一气体,既然已知最后有一种气体是H2O,则另一种便是CO2。13.B 14.C 15.AD 16.CD 酸式滴定管用蒸馏水洗后,由于其中还有蒸水,若直接加入标准盐酸溶液,其浓度被稀释,中和一定量NaOH,消耗的盐酸体积多,测得NaOH浓度偏大。称液管水洗后,若直接加入NaOH溶液,其浓度也被稀释,中和时消耗盐酸少,测得NaOH浓度偏低。正确的读数应平视,若开始时读数为仰视,由于视线错觉,液面“下降”了,读得盐酸体积比平视偏大,滴定后若俯视液面,由于视线错觉,液面“上升”了。(注意,滴定管的“0”刻度线在上),观察出的盐酸体积比平视又偏小,导致滴定消耗盐酸体积少,测得NaOH溶液浓度偏低。17.C 18.B
三、(22分)19.(8分) ①(1)HCI (2)NaOH (3)H2SO4 (4)NH3·H2O(每空1分)②Ba(OH)2取三支试管分别加入三种溶液中的一种,直接滴入Ba(OH)2溶液,无沉淀产生为HCl,再将HCl分别加入有白色沉淀的两支试管震荡,白色沉淀不消失的是H2SO4,白色沉淀消失的是H3PO4,(每空2分)
20(14分)①方法1:将CH3COONa晶体溶于适量水中,然后滴入酚酞溶液,显红色。方法2:取适量CH3COOH溶液,向其中加入中甲基橙溶液,呈红色,然后加入适量CH3COONa晶体,溶液颜色为橙色。(每空2分)②(10分)(1)OH—、K+、Cl—、SO2— 4 ; (2)Ba2+、Ag+、Fe3+、NO— 3 ;(各2分)(3)Fe、Ag(各1分); (4)OH—、Cl—、Fe+、Ag+、SO2— 4 、、、Ba2+(3分)KNO3(1分)
四、(18分)21(8分)Fe3+、Al3+、SO2— 4 、;HCO— 3 、Ba2+;NO— 3 、Cl— 、NH+ 4 (每答对1种离子给1分)
22(10分)D、CO2、F、NH3(各1分)A、NH4HSO4, B、Ba(HCO3)2(各2分);
“A”不能推(NH4)2SO4,因为其水溶液呈弱酸性,“B”不能推Ba(HSO3)2,因为其水溶液呈弱酸性。NH+ 4 +HCO— 3 +2OH—=NH3↑+CO2— 3 +2H2O(2分)
五、(23分)23(8分)(1)①②⑧③⑥ (2分)(2)A→B→C→K→J→D或A→C→B→K→J→D(2分)(3)8.5m×100%(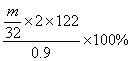 )(2分)(4)100ml(2分)
)(2分)(4)100ml(2分)
由:2Na2CO4 ~ O2↑
2×122 22.4
0.9mol VL
得:V=0.083L=83(ml)24(15分)(一)测定样品铜的质量分数(2分),(三)(2)
|
|
| ||||||
2H2O 2H2O+O2↑ (2分);(3)2Cu+O2 2CuO(1分) C+O2 CO2(1分)
(四、)![]() (2分)(五)(1)浓H2SO4,防止空气中CO2、H2O进入D中(1分)(2)偏低(2分)水蒸汽通过C被D中碱石灰吸收,m2偏大,导致结果偏低(2分)(3)在B、C之间接入盛有浓H2SO4的洗气瓶(或盛放碱石灰的干燥管)(2分)
(2分)(五)(1)浓H2SO4,防止空气中CO2、H2O进入D中(1分)(2)偏低(2分)水蒸汽通过C被D中碱石灰吸收,m2偏大,导致结果偏低(2分)(3)在B、C之间接入盛有浓H2SO4的洗气瓶(或盛放碱石灰的干燥管)(2分)
六、(15分)25(6分)(1)1、2、1、1(2分)甲醇21.28Kg,N2,8,9376×103L(4分)
解:设需甲醇的质量为xg ,生成的N2体积为YL,
(1)![]()
(2)6NH3 ~ 6NHO3 ~ 5CH3OH ~ 3N2
6 5 ×32 3×22.4
1000×0.95×0.84 x y
解得:x=21280(g)=21.82(kg) y=8.9376×103(L)
解:略
26(9分)(1)t℃和ρPa时D的气体密度ρ(g·L-1)或D气体的摩尔质量(g·mol—1)(2分)
m=19.5+11.0-3.00×ρ=30.5-3ρ (2分)或:19.5+11.0-![]()
(2)盐酸的物质的量浓度(Cmol/L)(1分)
计算式:Mg+2HCl=MgCl2+H2↑
24 2 得:C=4(mol/L)(1分)
0.48 0.01×C
![]() 讨论:①当C(HCl)≥4mol/L,应:Mg
H2↑
讨论:①当C(HCl)≥4mol/L,应:Mg
H2↑
24 22.4 VH2=0.448(L) (2分)
0.48 VH2
![]() ②当C(HCI)<4 mol/2 ,应:2HCl
H2↑
②当C(HCI)<4 mol/2 ,应:2HCl
H2↑
2 22.4
0.01×C VH2 VH2=0.112(L)(2分)
答:略。