高三化学期末试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共150分,考试时间120分钟.
相对原子质量:H—1 C—12 N—14 O—16 Mg—24 Si—28 P—31 S—32 Cl—35.5 Fe—56 Cu—64 Ag—108 Ba—137
第Ⅰ卷
每小题只有一个选项符合题意,每小题4分,共72分
1.为了减少城市空气污染,要求使用无铅汽油,所谓无铅汽油是指( )
A.不用铅桶装的汽油 B.不含四乙基铅的汽油
C.不含![]() 的汽油 D.不含氧化铅的汽油
的汽油 D.不含氧化铅的汽油
2.为了制取碘,可通过反应:![]()
![]()
![]() 制得,NO在制碘过程中的作用是( )
制得,NO在制碘过程中的作用是( )
A.还原剂 B.氧化剂
C.催化剂 D.反应物
3.浓硫酸常用于干燥气体,下列气体不能用浓![]() 干燥的是( )
干燥的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4.物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质
的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
A.①②③⑤ B.①②⑤
C.②⑤⑥ D.①④⑤⑥
5.![]() 表示阿伏伽德罗常数,以下说法不正确的是( )
表示阿伏伽德罗常数,以下说法不正确的是( )
A.16g臭氧中含有![]() 个氧原子
个氧原子
B.1mol![]() 中含有1mol共价键
中含有1mol共价键
C.0.5L pH=2的硫酸溶液中含有0.01![]() 个
个![]()
D.0.1mol![]() 晶体中含有0.1
晶体中含有0.1![]() 个阴离子
个阴离子
6.![]() 能与水发生如下发应:
能与水发生如下发应:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.该反应是氧化还原反应 B.该反应是复分解反应
C.![]() 是极性分子 D.
是极性分子 D.![]() 与碱溶液反应生成多种盐
与碱溶液反应生成多种盐
7.在恒容密闭容器中进行如下反应:![]()
![]()
![]() ,温度一定时,若将平衡体系中的各物质的浓度都增大到原来的2倍,则产生的结果是( )
,温度一定时,若将平衡体系中的各物质的浓度都增大到原来的2倍,则产生的结果是( )
A.平衡不发生移动
B.平衡向正反应方向移动
C .正反应速率增大,逆反应速率减小
D.![]() 的百分含量减小
的百分含量减小
8.下列各离子组中,能在水溶液中大量共存,当滴加稀硫酸后则不能大量共存的是(
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
9.图30-1两个装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol·![]() ,工作一段时间后,测得导线上都通过了0.02mol
,工作一段时间后,测得导线上都通过了0.02mol![]() ,若不考虑溶液体积的变化,则下列叙正
,若不考虑溶液体积的变化,则下列叙正
确的是( )
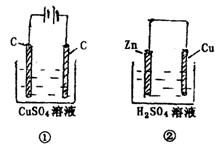
图30-1
A.产生气体体积:①=②
B.电极上析出固体质量:①<②
C.电极反应式:①中阳极:![]() ②中负极:
②中负极:![]()
D.溶液的pH变化:①减小;②增大
10.国家有关部门对家庭装饰材料进行抽查,发现具有毒气污染的材料占68%,它们会发出300多种能引发30多种疾病的有害物质、三氯乙烯就是其中一种,其化学式为![]() .下列对三氯乙烯的叙述,正确的是( )
.下列对三氯乙烯的叙述,正确的是( )
①该物质是由碳、氢、氧三种元素组成 ②该物质是由三氯乙烯分子构成的化合物
③该物质中碳、氢、氧的质量之比为2∶l∶3 ④该物质的分子是平面分子
A.只有①② B.只有①③
C.①②④ D.①③④
11.在实验室中,贮存物质或仪器洗涤方法错误的是( )
A.溴水可用细口滴瓶盛放
B.做完银镜实验后的试管可用稀硝酸溶液洗涤
C.白磷可贮存于水中
D.浓硝酸可用棕色细口瓶盛放
12.在pH为3的![]() 溶液,pH为11的
溶液,pH为11的![]() 溶液和pH为3的盐酸中由水电离出来的
溶液和pH为3的盐酸中由水电离出来的![]() 的浓度分别为:
的浓度分别为:![]() 、
、![]() 、
、![]() 它们之间的关系是( )
它们之间的关系是( )
A.![]() <
<![]() <
<![]() B.
B.![]() =
=![]() >
>![]()
C.![]() >
>![]() >
>![]() D.无法判断
D.无法判断
13.用水稀释0.1mol/L醋酸溶液时,溶液中随着水量的增加而减小的是( )
A.![]() B.
B.![]()
C.![]() 和
和![]() 的乘积 D.
的乘积 D.![]() 的物质的量
的物质的量
14.在t℃时,将一定量的![]() 溶液蒸发掉ag水后冷却到t℃,有mg
溶液蒸发掉ag水后冷却到t℃,有mg ![]() 析出,若再加热蒸发掉bg水并冷却到t℃,又析出ng
析出,若再加热蒸发掉bg水并冷却到t℃,又析出ng![]() ,用S表示t℃时
,用S表示t℃时![]() 的溶解度,下列算式一定正确的是( )
的溶解度,下列算式一定正确的是( )
A.S=1600m/(25a+9b) B.S=100n/b
C.S=100(m+n)/(a+b) D.S=1600n/(25b+9n)
15.从中草药茵陈蒿中可提取出一种利胆有效成分——对羟基苯乙酮:![]() 推
推
测该药物不具有的化学性质是( )
A.能跟氢氧化钠溶液反应
B.能跟浓溴水反应
C.能跟碳酸氢钠溶液反应
D.在催化剂存在时能还原生成醇类物质
16.在下列反应中,![]() ,化学计量数b、d分别为( )
,化学计量数b、d分别为( )
A.5,6 B.10,2 C.6,2 D.10,5
17.下列反应的离子方程式错误的是( )
A.少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
B.碳酸钙中滴入醋酸溶液:
![]()
C.明矾溶液与小苏打溶液混和:![]()
D.铁片投入硫酸铜溶液中:![]()
18.在隔绝空气的情况下,9.8g
Fe、Mg混合物溶于一定量某浓度的稀![]() 中,当金属完全溶解后,收集到0.2mol NO气体,在反应后的溶液中加入足量的烧碱溶液,可生成
中,当金属完全溶解后,收集到0.2mol NO气体,在反应后的溶液中加入足量的烧碱溶液,可生成
氧化物沉淀的质量为( )
A.18g B.20g C.22g D.无法计算
第Ⅱ卷
19.(10分)利用图30-2所示装置,选用适当试剂完成下述实验或得出相应实验结论:
(1)验证氧化性:![]()
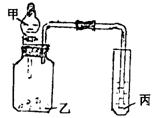
图30-2
所用试剂:甲_______________________,
乙_______________________,
丙_______________________(3分)
(2)所用试剂:甲:盐酸;乙:石灰石;丙:苯酚钠溶液
实验现象:丙中___________________________________________________,
实验结论:_______________________________________________________.(2分)
(3)请利用该装置自行设计一个实验,简述丙中实验现象及根据此现象所得出的实验
结论:(5分)
所用试剂:甲________________;乙________________;丙________________.
丙中现象:________________________________________________________;
实验结论:_______________________________________________________.
20.(11分)为证明有关物质的某些性质,某学生设计了图30-3所示实验装置,当打开活塞M,使某溶液a与搁板H上的块状固体b相遇时,即有气体产生,并发现D中蜡烛(烃类,用![]() 表示)慢慢熄灭,关闭M,打开N时,则看到G中蜡烛燃烧更亮:
表示)慢慢熄灭,关闭M,打开N时,则看到G中蜡烛燃烧更亮:
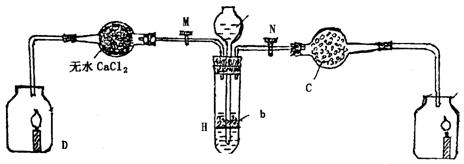
图30-3
(1)请写出在装置中有关仪器内盛放的物质:(3分)
a_____________________________________________________________;
b_____________________________________________________________;
c_____________________________________________________________.
(2)用化学方程式表示上述实验中发生的主要反应:(8分)
_________________________________________________________________________
_________________________________________________________________________
_________________________________________________________________________
_________________________________________________________________________
21.(9分)图30-4中,A是一种正盐,D比C的相对分子质量大16,E是酸,不论X是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一种元素;
![]()
图30-4
当X是强碱时,A、B、C、D、E均含有另一种元素;用化学式回答下列问题:
(1)A是____________;Y是____________;Z是_____________.(3分)
(2)当X是强碱时,E是________,A与X反应的离子方程式为________;(3分)
(3)当X是强酸时,E是________,A与X反应的离子方程式为________.(3分)
22.(10分)已知![]() 能发生如下反应:
能发生如下反应:![]()
(1)上述反应中的氧化剂是________________;若有0.75mol的还原剂被氧化,则被
还原的氧化剂是________mol.(3分)
(2)
![]() 有像食盐一样的咸味,误食会使人中毒,可以用试剂和生活中常见的物
有像食盐一样的咸味,误食会使人中毒,可以用试剂和生活中常见的物
质进行实验鉴别![]() 和NaCl,现有物质:
和NaCl,现有物质:
①自来水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒进行实验时,必须选
用的物质有________________(填编号).(2分)
3)某厂废液中含2%的![]() ,直接排放会造成污染,下列试剂中
,直接排放会造成污染,下列试剂中
①NaCl ②![]() ③
③![]() ④浓
④浓![]() 能使
能使![]() 转化为不引起二次污染的
转化为不引起二次污染的![]() 的是________(填编号),反应的化学方程式为________.(5分)
的是________(填编号),反应的化学方程式为________.(5分)
23.(9分)两个碳碳双键被一个碳碳单键隔开的二烯烃,叫做共轭二烯烃,共轭二烯烃跟等物质的量的![]() 加成时,可发生1、2加成,也可发生1、4加成:
加成时,可发生1、2加成,也可发生1、4加成:
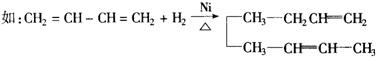
某有机物的结构简式为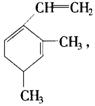 ,当它与等物质的量的
,当它与等物质的量的![]() 的水溶液发生加成反
的水溶液发生加成反
应时有多种产物,请补写其他几种产物的结构简式.
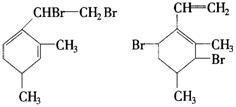
_________________________________________________________________________
_________________________________________________________________________
_________________________________________________________________________
24.已知羧酸在磷的催化作用下,可以和卤素反应生成a —卤代物:如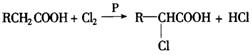 ,Ⅰ由二分子G合成,有机物A在一定条件下,
,Ⅰ由二分子G合成,有机物A在一定条件下,
最终转化成I的过程如图30-5:(13分)
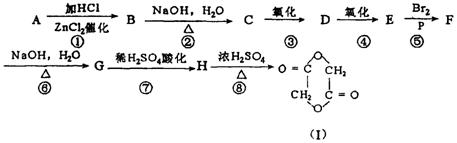
图30-5
回答下列问题:
(1)写出有机物的结构简式:
A______________________________________________________________________
E______________________________________________________________________
H______________________________________________________________(3分)
(2)上述各步反应中,属于取代反应的有(填编号)________(4分)
(3)写出有关反应方程式:(6分)
B→C:________________________________________________________________
C→D:________________________________________________________________
H→I:_________________________________________________________________
25.(8分)某元素可能是磷、铁、镁、碳中的一种,将其单质11.2g与足量氯气充分反应(一定条件下,上述四种元素的单质均可以跟![]() 反应)得到32.5g相应氯化物,通过
反应)得到32.5g相应氯化物,通过
计算和讨论,确定该元素是哪种元素.
26.(8分)将1.95g由![]() 和
和![]() 组成的混合物溶于水得溶液A,在A中加入10ml未知浓度的
组成的混合物溶于水得溶液A,在A中加入10ml未知浓度的![]() 溶液恰好完全反应,过滤得沉淀B和滤液C,在C中加入足量
溶液恰好完全反应,过滤得沉淀B和滤液C,在C中加入足量![]() 溶液,反应后又得沉淀5.74g,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g
溶液,反应后又得沉淀5.74g,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g
计算:
(1)![]() 溶液的物质的量浓度;
溶液的物质的量浓度;
(2)原混合物中![]() 的质量分数.
的质量分数.
参考答案
1.B 2.C 3.D 4.B 5.C 6.A 7.B 8.D 9.D 10.C 11.A 12.B13.B
14.D 15.C 16.B 17.A 18.B 19.(1)浓盐酸![]() 、KBr溶液
、KBr溶液
(2)溶液变混浊 酸性:HCl>![]() >
>![]()
(3)水 ![]() 溴水 溴水褪色 乙炔能使溴水褪色(只要答案合理亦可)
溴水 溴水褪色 乙炔能使溴水褪色(只要答案合理亦可)
20.(1)盐酸 ![]()
![]()
(2)![]()
![]()
![]()
![]()
21.(1)![]()
![]()
![]()
(2)![]()
![]()
(3)![]()
![]()
22.(1)![]() 0.75mol (2)② ⑤
0.75mol (2)② ⑤
(3)② ![]()
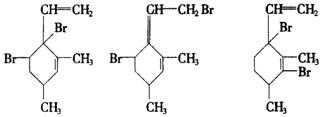
23.
24.(1)![]() ,
,![]() ,
,![]()
(2)②⑤⑥⑦
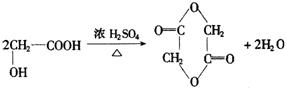
(3)![]()

25.解:与11.2g单质反应的![]() 的物质的量为:
的物质的量为:![]()
则失去1mol![]() 的单质的质量为:
的单质的质量为:![]()
若1摩此单质与![]() 反应时失去1摩电子,则此元素相对原子质量为
反应时失去1摩电子,则此元素相对原子质量为![]() ,不合题意.
,不合题意.
若1摩此单质与![]() 反应时失去2摩电子,则此元素相对原子质量为
反应时失去2摩电子,则此元素相对原子质量为![]() ,不合题意.
,不合题意.
若1摩此单质与![]() 反应时失去3摩电子,则此元素相对原子质量为56.所以,此元素为Fe.
反应时失去3摩电子,则此元素相对原子质量为56.所以,此元素为Fe.
26.解:![]() 则
则![]()
所以![]()
![]() 质量增加
质量增加
1mol 36g
xmol 0.18g
x=0.005mol 所以:![]() 的质量为:106g/mol×0.005mol=0.53g
的质量为:106g/mol×0.005mol=0.53g
所以:![]() 的质量分数为:
的质量分数为:![]()