高三第一学期期初考试化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷1至3页,第II卷4至9页,共150分。考试时间120分钟。
第I卷(选择题 共46分)
可能用到的原子量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Al: 27 S:32 Cl:35.5 Ca:40 Zn:65 Ba:137
一、 选择题(本题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意。)
1.下列说法,违反科学原理的是( )
A.碘化银可用于人工降雨 B.闪电时空气中的N2可变为氮的化合物
C.添加少量某物质可将水变成燃料油 D.在一定温度、压强下石墨可变成金刚石
2.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
 |
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
3.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
4.将0.1mol/LCH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增加
B. CH3COOH电离度变大
C. 溶液的导电能力减弱
D.溶液中[OH-]减小
5.将Cu片放入0.1mol /L FeCl3溶液中,反应一定时间后取出Cu片,溶液中[Fe3+]:[Fe2+]=2:3,则Cu2+与Fe3+的物质的量之比为( )
A.3:2 B.3:5 C.4:3 D.3:4
6.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
二、 选择题(本题包括7小题,每小题4分,共28分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
7.第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径大 D.碳酸盐难溶于水
8.下列各组混合物不能用分液漏斗分离的是( )
A.硝基苯和水 B.苯和甲苯 C.溴苯和NaOH溶液 D.甘油和水
9.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+ Ba2+ Cl- SO42- B.H+ NH4+ Al3+ SO42-
C.K+ AlO2- NO3- OH- D.H+ Cl- CH3COO- NO3-
10.为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入( )
A.水;无水CaCl2 固体 B.饱和NaHCO3溶液,浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液 D.饱和 Na2CO3溶液;稀H2SO4
11.下列反应的离子方程式正确的是( )
A.硫酸铝溶液和小苏打溶液反应 Al3++3HCO3-==3CO2↑+Al(OH)3↓
B.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
C.硫化亚铁中加入盐酸 S2-+2H+== H2S↑
D.钠和冷水反应 Na+2H2O==Na++H2↑+2OH-
12.将一定质量的Mg 、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物的质量可能是( )
A.2g B.4g C.8g D.10g
![]() 13.反应L(固)+aG(气)
bR(气)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判断:
13.反应L(固)+aG(气)
bR(气)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。据此可判断:
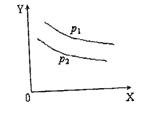 A.上述反应是放热反应
B.上述反应是吸热反应
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b D.a<b
第II卷(非选择题 共104分)
三、本题包括3小题,30分。
14.(8分)填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:__________________。
(2)周期表中位于第8纵行的铁元素属于第______________族。
(3)周期表中最活泼的非金属元素位于第_________纵行。
(4)所含元素超过18种的周期是第_________、__________周期
15.(10分)化合物BrFx与水按物质的量之比3:5发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1)BrFx中,x=______________________。
(2)该反应的化学方程式是:______________________________________。
(3)此反应中的氧化剂和还原剂各是什么?______________________________。
16.(12分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答:
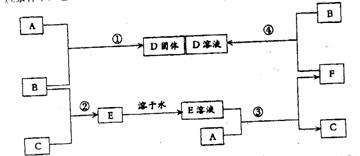
(1)A是_________________、B是_____________、C是_______________(请填化学式)
(2)反应①的化学方程式为:_______________________。
(3)反应③的化学方程式为:_______________________。
(4)反应④的化学方程式为: ________________________。
四、本题共3小题,26分。
17.(5分)用pH试纸测定溶液的pH,正确操作是:
____________________________________________________________________________________________________________________________________-。
18.(7)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:________________________________________ .
(2)这四种溶液分别是甲:_________ 、乙:_________、丙:_______、丁:_______。
19.(14分)长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
① 称量a g样品,置于烧杯中。
② 加入适量蒸馏水,使样品溶解。
③ 加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液
④ 过滤,用蒸馏水洗涤沉淀。
⑤ 加热干燥沉淀物。
⑥ 将沉淀物冷却至室温后,称量。
⑦ 重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?其理由是:
_________________________________________________________________________________________________________________________________________________________。
(2)步骤③中加盐酸使溶液呈强酸性的目的是:
________________________________________________________________________________________________________________________________________________________。
(3)步骤⑦的“合格”标准是:_____________________________________________ .
(4)实验测得样品中无水亚硫酸钠的质量分数是:
__________________________________________________________________________。
(列出算式,不需化简)
五、本题包括3小题,共25分
20.(4分)某含氧有机化合物可以作为无铅汽油的抗爆震剂,它的分子量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。
_________________________________________________________________________。
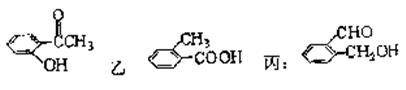
21.(12分)今有化合物甲:
(1)请写出丙中含氧官能团的名称:_______________________________________。
(2)请判别上述哪些化合物互为同分异构体:_______________________________________。
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:
_______________________________________________________________________。
鉴别乙的方法:
____________________________________________________________________。
鉴别丙的方法:
_____________________________________________________________________。
(4)请按酸性由强至弱排列甲、乙、丙的顺序:______________________________。
22.(9分)烯烃A在一定条件下可以按下面的框图进行反应:
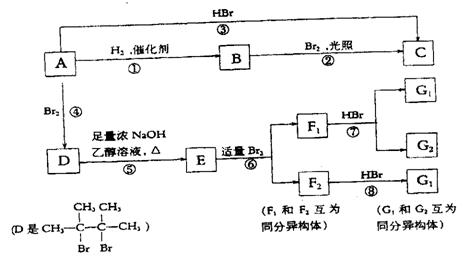
 |
已知:CH3CH2CH2CH2CH2 CH2Br CH3CH2CH2CH2CH=CH2
请填空:
(1)A的结构简式是:______________________________________________。
(2)框图中属于取代反应的是(填数字代号):__________________________。
(3)框图中①、③、⑥属于__________________________反应。
(4)G1的结构简式是:______________________________________________。
六、本题包括2小题,共23分。
23.(7分)已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其式量以3.60×103计)0.504g。试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0计)。
24.(16分)将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol/L的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3=750mL时,沉淀量不再改变。
(1)最初加入的50mL NaOH溶液的作用是什么?
(2)计算所用硫酸的浓度。
(3)试判断两种氧化物各是什么,并计算其物质的量。
【参考答案】
一、 选择题
1.C 2.C 3.A 4.A 5.D 6.B 7.CD 8.BD 9.C 10.AB 11.A 12.BC 13.BD
二、 填写
14. (1) ![]() (2)Ⅷ (3)17 (4)六、七
(2)Ⅷ (3)17 (4)六、七
15.(1)3 (2) 3BrF3+5H2O=HBrO3+9HF+Br2+O2
(3)
![]() 氧化剂-BrF3; 还原剂-BrF3、H2O
氧化剂-BrF3; 还原剂-BrF3、H2O
16.(1)Fe 、 Cl2、H2 (2) 2Fe+3Cl2 2FeCl3
(3) 2HCl+Fe=FeCl2+H2↑ (4) 2FeCl2+Cl2=2FeCl3
17.在玻璃片上放置pH试纸,用玻璃棒(干燥、洁净)蘸取待测液滴在pH试纸中央,待试纸变色一段时间后对照标准比色卡读取pH。
18.(1)2H++CO32-=H2O+CO2↑
(2) CaCl2 Na2CO3 AgNO3 HCl (盐酸)
19.(1)不能 酸性条件下, NO3-可以将SO32-氧化成SO42-,影响测定结果。
(2)保证产生的沉淀全部是BaSO4而不会BaSO3
(3)连续两次称量结果一致
(4)(a g-![]() )·
)·![]()
20.略
21.(1)羟基 醛基
(2)甲、乙、丙均互为同分异构体。
(3)鉴别甲:与FeCl3溶液反应显紫色的是甲
鉴别乙:与Na2CO3溶液反应产生气泡的是乙
鉴别丙:与银氨溶液(水溶加热)产生银镜的是丙
(4)乙>甲>丙
22.(1)CH3-C = C-CH3
(2)②
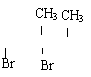 (3)加成
(3)加成
(4)CH2-C-CH-CH2Br
六、23. 8.43%
24.(1) 中和过量的酸
(2)3.25mol/L
(3) Al2O3
nAl![]() O
O![]() =0.00500mol
=0.00500mol
Fe2O3
nFe2O![]() =0.00500mol
=0.00500mol