高三化学单元检测
——电解质溶液、中和滴定、物质结构
相对原子质量:N—14 P—31 Cl—35.5 Ba—137 Ti—48 O—16
一、选择题(每小题有1-2个正确答案,每小题5分,共60分)
1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。根据以上叙述回答1、2两小题:
1.对于C60与棒碳,下列说法正确的是 ( )
A.C60在一定条件下可能与CuO发生置换反应 B.C60摩尔质量是720
C.棒碳中所有的化学键都是非极性共价键 D.棒碳是原子晶体
2.对于金刚石、石墨、活性炭、C60与棒碳,下列说法正确的是 ( )
A.都是碳的同素异形体 B.都是碳的同位素
C.它们的物理性质不同 D.棒碳化学性质很稳定
3.下列物质按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是 ( )
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.冰醋酸、福尔马林、硫酸钡、氟化氢、乙醇
C.单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫
D.胆矾、漂白粉、氯化钾、次氯酸、氯气
4.下列物质变化时,需克服的作用力不属于化学键的是 ( )
A.HCl溶于水 B.I2升华 C.H2O电解 D.烧碱熔化
5.用中和滴定测定某盐酸的浓度,操作如下:用天平称得20gNaOH,配成1000mL标准溶液,用来测定大约浓度为1mol/L的盐酸50mL,假设配得的NaOH溶液直接用来测定,该实验允许误差为一滴(约0.05mL),那么称取NaOH固体的天平的准确度在下列数据中哪个比较合理? ( )
A.0.1g B.0.01g C.0.001g D.0.0001g
6.氡是放射性稀有元素,氡气吸入体内有害健康。氡的原子序数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86、质量数219的原子组成。下列有关氡的说法正确的是 ( )
A.氡气在标准状况下密度约是9.91g/L
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同素异形体
7.PH=3的盐酸与PH=10的氢氧化钡溶液混合,若使混合液的PH=7,则盐酸与氢氧化钡溶液的体积比应为 ( )
A.1:10 B.1:5 C.1:20 D.1:2
8.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟
液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是 ( )
A.跟水反应时,水作氧化剂 B.NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2生成 D.跟乙醇反应时,NaH被氧化
9.下列各组物质性质的比较中,错误的是
A.熔点:Ca>K>Rb>Cs B.酸性:H2CO3<H3PO4<H2SO4<HClO4
C.半径:K+>Na+>O2->F- D.热稳定性:SiH4<NH3<PH3<H2O
10.将0.03mol Cl2缓缓通入含0.02mol H2SO3和 0.02mol HBr的混和溶液中,在此过程中,溶液中的[H+]与Cl2用量的关系示意图是(溶液的体积不变) ( )
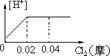
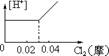
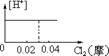
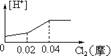
A B C D
11.在蒸发皿中蒸干并灼烧下列物质的溶液,可以得到该溶质的是 ( )
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
12.将等体积的0.4mol/LCH3COONa和0.2mol/LHNO3溶液混和,溶液呈酸性,则混和液中下列关系正确的是 ( )
A.c(Na+)>c(CH3COO-)>c(NO3-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(H+)>c(NO3-)>c(OH-)
C.将混和溶液加水稀释过程中,c(H+)/c(CH3COOH)的比值变小
D.将混和溶液稀释1010倍以后,溶液的pH值接近7,c(NO3-)=10-11mol/L
二、填空题(共40分)
13.(5分)1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。按已知的原子结构规律,118号元素应是第 周期第 族元素,它的单质在常温常压下最可能呈现的状态是 (气、液、固选一填入)态。近日传闻俄国合成了第166号元素,若已知原子结构规律不变,该元素应是第 周期第 族元素。
14.(4分)在有机溶剂里m molPCl5跟m molNH4Cl定量地发生完全反应,生成4m molHCl,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,在1Pa下测得R的蒸气密度折算成标准状况下则为15.54g.L-1。请回答:
(1)通过计算推导R的化学式________________。
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R分子中环境相同,磷
原子形成的化学键多于氮原子,写出R的分子结构式__________________________。
15.(9分)有A、B、C三种元素,它们之间形成AB型化合物。已知B和C原子电子层数相等,而最外层电子数之和为10。A2+和B原子具有相同的电子层数;C原子最外层电子数为次外层电子数的3倍,回答:
(1)A、B、C三种元素符号为A_______、B_______、C_______。
(2)画出A离子的结构示意图_____________________。
(3)写出BC2的结构式_________,该化合物固态时属于________晶体,其中的化学键为___________键。
(4)用电子式表示AC的形成过程____________________________________。
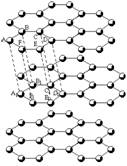
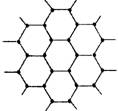 16.(4分)石墨的片层与层状结构如右图:其中C—C键长为142pm,层间距离为340pm。试回答:
16.(4分)石墨的片层与层状结构如右图:其中C—C键长为142pm,层间距离为340pm。试回答:
(1)片层中平均每个六元环含碳原子数为
个;在层状结构中,平均每个六棱柱(如ABCDEF—A1B1C1D1E1F1)含碳原子数 个。
(2)在片层结构中,碳原子数、C—C键数、
六元环数之比_____。
17.(8分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。回答下列问题:
(1)写出Be与NaOH反应生成Na2BeO2的离子方程式_________________________。
(2)Be(OH)2与Mg(OH)2可用________试剂鉴别,其离子方程式为__________
_________________________________。
(3)BeCl2是__________________化合物(填“共价”或“离子”)。
(4)根据对角线规则,金属Li与Mg性质也相似。则Li在空气中燃烧主要产物的电子式是________________;同时还有少量___________生成。
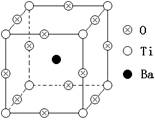 18.(10分)右图所示为PTC元件(热敏电阻)的主要成分——钡钛矿晶体结构,该结构是具有代表性的最小重复单位。该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm(1pm=10-12m),顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
18.(10分)右图所示为PTC元件(热敏电阻)的主要成分——钡钛矿晶体结构,该结构是具有代表性的最小重复单位。该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm(1pm=10-12m),顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
(1)写出晶体的化学式 ;
(2)在该物质的晶体中,每个Ti4+周围与它最邻近的且距离相等的Ti4+有________个,它们在空间呈什么形状分布? ;
(3)计算该晶体密度。
1、A 2、C 3、B 4、B 5、B 6、A 7、A 8、B 9、CD 10、A 11、C 12、AD
13、七 零 气 八 ⅥA 14、P3N3Cl6
15、(1)Mg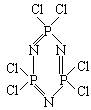 、C、O
、C、O
(2)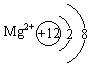
(3)O=C=O,分子,共价
(4)![]()
16、(1)2,2 (2)2:3:1
17、Be+2OH-=BeO2-+H2(2)NaOH溶液,Be(OH)2+2OH-=BeO22-+2H2O(3)共价,![]() ,Li3N
,Li3N
18、(1)BaTiO3(2)6,正八面体(3)5.91g.cm-3