高考热点五------溶液、胶体、PH专题
一、溶液中离子浓度大小比较
1、电解质溶液混合或稀释后,离子浓度相对大小的比较常分为三种类型:
(1)单一溶液中离子浓度相对大小的比较。如:判断一元或多元弱酸溶液和水解的盐溶液中离子浓度的相对大小。判断水解的盐溶液中离子浓度相对大小的一般方法是:
①若为NH4Cl等盐中的阴、阳离子且等价时,离子浓度为:
[不水解的离子] > [水解的离子] > [水解后呈某性离子(如H+或OH-)] > [水解后呈某性的对立离子]
例如: 在NH4Cl溶液中,其离子浓度:[Cl-]>[NH4+]>[H+]>[OH-]
②若为Na2CO3等盐中的阴阳离子的价数不等时,判断离子浓度的大小则要根据实际情况具体分析。对于多元弱酸根的水解几步,在分步水解中第一步水解为主。
例如:在Na2CO3溶液中,其离子浓度为:[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+].
③ 多元弱酸及其盐溶液,如:NaH2PO4溶液中: [Na+]>[H+]>[H2PO4-]>[HPO42-]>[PO43-]>[OH-]
Na3PO4溶液中:[Na+]>[PO43-]>[OH-]>[HPO42-]>[H2PO4-]>[H+]
NaHCO3溶液中,溶液显碱性,水解大于电离[Na+]>[HCO3-]>[OH-]>[H+]>[CO32-]
④混合溶液中, 如1:1的NH4Cl、NH3.H2O混合液中,,因NH3.H2O电离程度大于NH4+水解程度,则有: [NH4+]>[Cl-]>[OH-]>[H+] ; 又如:在1:1的HAc-NaAc混合液,因HAc电离程度大于水解程度,则有:[Ac-]>[Na+]>[HAc]>[H+]>[OH-]
(2)多种溶液中指定离子浓度相对大小的比较。
(3)两种溶液混合后离子浓度相对大小的比较。其解题的基本规律首先是判断两种电解质能否反应;其次是看反应物是否过量;第三是分析电解质在水溶液中电离及可能存在的电离平衡、水解平衡等问题;最后比较离子浓度的相对大小。
2、判断溶液中离子浓度相对大小的两个原理
(1)电荷守恒
溶液中阴、阳离子所带的正、负总电荷数值相等,即电解质溶液呈中性。
如溶液中含有:Aa-、Bb-、Cc+、Dd+四种离子,则有a[Aa-]+ b[Bb-]= c[Cc+]+ d[Dd+]
如:HAC中:[H+]=[AC-]+[OH-] NH4Cl中 : [NH4+]+[H+]=[Cl-]+[OH-]
Na2CO3中[Na+]+[H+]=[OH-]+[HCO3-]+2[CO32-]
(2)物料守恒
指电解质溶液中某一组分的原始浓度(起始浓度)应等于它在溶液中各种存在形式的浓度之和。
如:在NaHCO3溶液中:[NaHCO3]= [Na+]=[HCO3-]+[H2CO3]+[CO32-]
例1、等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是…………………………………
A、NH4Cl B、NH4HCO3 C、NH4HSO4 D、NH4NO3
例2、0.1mol/L的NaOH和0.1mol/L的NH4Cl溶液等体积混合,离子浓度大小次序正确的是( )
A、[Na+]>[Cl-]>[OH-]>[H+] B、[Na+]=Cl-]>[OH-]>[H+]
C、[Na+]=[Cl-]>[H+]>[OH-] D、[Cl-]>[Na+]>[OH-]>[H+]
例3、在25℃时,在浓度为1mol/L的(NH4)2SO4 、(NH4)2CO3 、 (NH4)2Fe(SO4)2的溶液中,测得其中[NH4+]分别为a、b、c,下列判断正确的是……………………………………………………………
A、a=b=c B、a>b>c C、a>c>b D、c>a>b
例4、物质的量浓度相同的下列各组物质的溶液中,对指定的离子浓度作大小比较,其中错误的
A、[PO43-]: Na3PO4>Na2HPO4>NaH2PO4>H3PO4
B、[CO32-]:(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3
C、[NH4+]:(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl D、[S2-]:Na2S>H2S>NaHS
例5、物质的量浓度相同的下列溶液按pH值由大到小的顺序排列,正确的是………………( )
A、Na2CO3>NaAlO2>Na2SiO3>NaHCO3 B、CH3COONa>Na2CO3>C6H5ONa>NaHCO3>NH4Cl
C、NaAlO2>Na2SiO3>Na2CO3>NaHSO4>NH4Cl D、Ba(OH)2>NaOH>NH3·H2O>NaCl>Al2(SO4)3
例6、表示0.1mol/LNaHCO3溶液中有关微粒浓度(mol/L)的关系式,正确的是……………………
A、[Na+]>[S2-]>[OH-]>[HS-] B、[OH-]=2([HS-]+[H+]+[H2S])
C、[OH-]=[HS-]+[H+]+2[H2S] D、[Na+]+[H+]=[OH-]+[HS-]+[S2-]
二、酸式盐溶液的酸碱性判断
如果不考虑阳离子水解的因素,单纯考虑酸式盐酸根离子,那么酸式酸根离子在水溶液中既可以电离又可能水解。
(1)、强酸的酸式盐只电离,不水解,一定显酸性。如:NaHSO4
(2)、弱酸酸式盐存在两种趋势:HR-=H++R2-(电离,显酸性),HR-+H2O=H2R+OH- (水解,显碱性),很显然如果电离趋势占优势,则显酸性,如:H2PO4-、HSO3-,如果水解趋势占优势,则显碱性;如HCO3-、HS-、HPO42-等。
三、关于溶液PH值的计算
1、单一溶液的PH计算①强酸溶液,如HnA,设浓度为C mol.L-1,[H+]=nc,PH=-lg nC
②强碱溶液,如B (OH)n,设浓度为C mol/L,[H+]=10-14/nc,Ph=14+lg nC
③一元弱酸溶液,设浓度为c mol/L电离度为α ,[H+]=cα PH= -lg[H+]= -lgcα
④一元弱碱溶液,PH= -lg[H+]=14+lgcα
2、计算方法
(1)两强酸混合:[H+]混=([H+]1V1+[H+]2V2)/(V1+V2)
(2)两强碱混合: [OH-]混=([OH-]1V1+[OH-]2V2)/ (V1+V2)
(3) 酸碱混合一者过量:[OH-]混或[H+]混= [H+]酸V酸-[OH-]碱V碱 / (V酸+V碱)
(4) 两强等体相混时的近似速算(若PH1>PH2)
混合前 混合后
PH1+PH2≥15 PH1-0.3
PH1+PH2=14 =7
PH1+PH2≤13 PH2+0.3
四、关于溶液计算
1.基本公式及关系:
(1)
物质的量浓度:① 。
。
②稀释过程中溶质不变:C1V1=C2V2。
③同溶质的稀溶液相互混合:C混=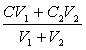
④质量分数换算为物质的量浓度:C=![]()
(2)溶质的质量分数。
①![]() ②
②![]() (饱和溶液,S代表溶质该条件下的溶解度)③混合:m1a1%+m2a2%=(m1+m2)a%混④稀释:m1a1%=m2a2%
(饱和溶液,S代表溶质该条件下的溶解度)③混合:m1a1%+m2a2%=(m1+m2)a%混④稀释:m1a1%=m2a2%
(3)有关溶解度的计算:
①S=![]() (饱和溶液:一定温度下)
(饱和溶液:一定温度下)
②把不饱和溶液变为饱和溶液的计算:Ⅰ. 蒸发溶剂法Ⅱ. 恒温加入溶质的方法:
跟踪训练:
(03江苏)1.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为
A ![]() B
B ![]() C
C ![]() D
D ![]()
(03江苏)2.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
(99全国)3.已知25%氨水的密度为0.91g.cm-3,5%氨水的密度为0.98g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
A. 等于15% B.大于15% C.小于15% D.无法估算
(99全国)4、pH=13的强碱溶液pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是
(A)11:1 (B)9:1 (C)1:11 (D)1:9
(98全国)5、将标准状况下的aLHCl(气)溶于1000g水中,得到盐酸密度为bgcm-3,则该盐酸的物质的量深度是
(A)a/22.4molL-1
(B)ab/22400molL-1
(C)ab/(22400+36.5a)molL-1
(D)1000ab/(22400+36.5a)molL-1
(03上海)6.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A c(A-)=c(K+) B c(H+)=c(OH-)<c(K+)<c(A-)
C V总≥20mL D V总≤20mL
(02上海)7.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A 冷水 B 沸水 C NaOH浓溶液 D NaCl浓溶液
(01上海)8.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A 分散质颗粒直径都在l~100nm之间 B 能透过半透膜
C 加热蒸干、灼烧后都有氧化铁生成 D 呈红褐色
(00上海)9、下列物质的水溶液能导电,但属于非电解质的是
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
(04南通)10、下列溶液一定呈酸性的是
A.含有H+离子的溶液 B.c(OH‑)<c(H+)的溶液
C.滴加酚酞显无色的溶液 D.pH小于7的溶液
(04淮安)11、某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水,得v mL饱和溶液,测得该溶液的密度为ρg/cm3,其中n(A-)为b mol。下列叙述中,错误的是
A.溶液中c(H+)=[1000b+c(OH-)V]/V mol/L
B.物质的量浓度c(HA)=1000a/MV mol/L
C.t℃时,HA的溶解度S=100a/ρV g
D.HA的质量分数ω(HA)=(a/ρV)×100%
(04淮安)12、有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
(04考试)13、 25°C,在某物质的溶液中由水电离出的H+浓度为1×10-amol.L-1下列说法不正确是
A.a<7时,水的电离受到抑制 B.a>7时,水的电离受到抑制
C,a<7时,溶液的pH一定为a D.a>7时,溶液的pH一定为14-a
(04考试)14、将溶质的质量分数为a%、物质的量浓度为c1mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为c2mol/L.则c1和c2的关系是
A.c2=2c1 B.c2<2c1、 C.c2>2c1 D.c1=2c2
(04徐州)15、现有m1 g KCl饱和溶液,其溶质的质量分数为c1%,对其采取某种措施后析出m g KCl晶体,母液质量为m2 g,其溶质的质量分数为c2%,则下列关系中正确的是
A.c1一定大于c2 B.原条件下KCl的溶解度小于c1 g
C.m1-m2≤m D.m1c1-100m=m2c2
(04扬州)12.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于 ( )
A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2