<化学反应 速率化学平衡>单元训练题
第I卷(选择题,共45分)
一、 选择题(本题包括9小题,每小题5分,共10分。每小题只有一个选项符合题意。)
1.在下列过程中,需要加快化学反应速率的是 ( )
A.钢铁腐蚀 B.食物腐败 C.炼钢 D.塑料老化
2.在一定温度和压强下,N2+3H2![]() 2NH3达到平衡,下列说法使平衡不发生移动的是 ( )
2NH3达到平衡,下列说法使平衡不发生移动的是 ( )
A.恒温恒压时充入氨气 B.恒温恒容时充入氮气
C.恒温恒容时充入氦气 D.恒温恒压时充入氦气
3.可逆反应:CO(g)+NO2(g)![]() CO2(g)+NO(g);△H=-226kJ/mol,在下列情况下不能使反应率加快的是
( )
CO2(g)+NO(g);△H=-226kJ/mol,在下列情况下不能使反应率加快的是
( )
A.充入NO2 B.升高温度 C.减小压强,扩大容器体积 D.增加压强,缩小容器体积
4.在恒温时,一固定容积的容器中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比,NO2(g)的体积分数 ( )
N2O4(g)达到平衡后,再向容器内通入一定量NO2(g),重新达到平衡后,与第一次平衡时相比,NO2(g)的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
5.把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+B(g)![]() 2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
( )
2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
( )
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
6.某反应:2A(g)![]() B(g)+C(g),在甲、乙两个容积都是1L且不变的容器中进行,开始时在两个容器中均放入0.5molA,甲容器3s后B的物质的量浓度达到0.18mol/L,且保持不变;乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则
( )
B(g)+C(g),在甲、乙两个容积都是1L且不变的容器中进行,开始时在两个容器中均放入0.5molA,甲容器3s后B的物质的量浓度达到0.18mol/L,且保持不变;乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则
( )
A. 乙容器中使用了比甲容器中更高的温度
B. 乙容器加入了某种不与体系气体反应的气体增大了容器的压强
C.乙容器中使用催化剂
D.乙容器中可能既升高了温度又使用了催化剂
7.某温度下的一固定容器中,发生如下反应 2E(g)![]() F(g)+G(g)(正反应为吸热反应)
F(g)+G(g)(正反应为吸热反应)
若起始时E为a mol·L-1,F、G均为0,达平衡时E为0.5a mol·L-1;若E的起始浓度改为2a mol·L-1 ,F、G仍为0,当达到新的平衡时,下列说法不正确的是 ( )
A.新平衡下E的体积分数为50% B.新平衡下F的平衡浓度为0.5a mol·L-1
C.新平衡下E的物质的量a mol D.化学反应速率后者比前者快
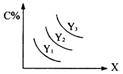 8.对于反应A(s)+2B(g)
8.对于反应A(s)+2B(g)![]() 3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是
3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是
A.Y表示温度,X表示压强,且Y3>Y2>Y1
B.Y表示压强,X表示温度,且Y3>Y2>Y1
C.X表示压强,Y表示温度,且Y1>Y2>Y3
D.X表示温度,Y表示压强,且Y1>Y2>Y3
9.一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
A.c1∶c2=1∶3
B.平衡时,Y和Z的生成速率之比为3∶2
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
A.c1∶c2=1∶3
B.平衡时,Y和Z的生成速率之比为3∶2
C.X、Y的转化率不相等 D.c1的取值范围为0<c1<0.14 mol·L-1
第I卷答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
第II卷(非选择题,共55分)
10.(12分)①将1mol CO(g)和1mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),此时有2/3的CO转化为CO2。
CO2(g)+H2(g),此时有2/3的CO转化为CO2。
该平衡混合物中CO2的体积分数为 (用三位百分数表示)。
②若在相同条件下,向容器中充入1 mol CO2、1 mol H2和1 mol H2O,则达到平衡时与①相比较,平衡应向 移动(填“正反应方向”、“逆反应方向”或“不”),此时平衡体系中CO2的体积分数可能是下列各值中的 (填编号)
A. 22.2% B.27.6% C.33.3% D.36.8%
11.(10分)钾是一种活泼的金属,工业上通常用金属钠和氯化钾的高温下反应制取。该反应为:
Na(1)+KCl(1)![]() NaCl(1)+K(g);△H>0
NaCl(1)+K(g);△H>0
各物的沸点与压强的关系见下表。
| 压强(kpa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃) | 590 | 710 | 770 |
| Na的沸点(℃) | 700 | 830 | 890 |
| KCl的沸点(℃) | 1437 | ||
| NaCl的沸点(℃) | 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料转化率可以采取的措施是 。
12.(8分)向氢氧化钙悬浊液中加入少量Na2CO3固体,Ca(OH)2的量会 ,用必要的化学用语和文字解释之: 。
 13.(15分)一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,则得乙容器中N2O4 的浓度为0.09mol·L-1。经过60s,乙容器中反应到平衡。(反应过程中两个容器的温度均保持恒定)。
13.(15分)一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,则得乙容器中N2O4 的浓度为0.09mol·L-1。经过60s,乙容器中反应到平衡。(反应过程中两个容器的温度均保持恒定)。
(1)前2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(2)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,以下同);容器内的N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
(3)若要使甲、乙中N2O4浓度相等,不能采取的措施是 (填选项的标号)。
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
14.(10分)在1273K时在体积为1L的密闭容器中测得可逆反应:Fe(s)+H2O(g)![]() FeO(s)+H2(g)达到化学平衡状态时:n(H2)/n[H2O(g)]=1.49。试解答下列问题(本题结果要求保留三位有效数字):
FeO(s)+H2(g)达到化学平衡状态时:n(H2)/n[H2O(g)]=1.49。试解答下列问题(本题结果要求保留三位有效数字):
(1)每生成1.00 mol H2时,需通入水蒸气物质的量为多少?
(2)在1273K时,若向上述密闭容器中投入0.80mol还原铁粉,通入1.00mol水蒸气,当达到化学平衡状态时,求密闭容器中各组分物质的量。
<化学反应 速率化学平衡>单元训练题参考答案
1.C 2.C 3.C 4.C 5.C 6.C 7.C 8.A 9.C
10.①33.3%②正反应方向;B
11.(1)770℃;890℃ (2)降低压强或抽去钾蒸气,适当升高温度
12.减少;在氢氧化钙悬浊液中,有Ca(OH)2 (S) ![]() Ca2++2OH-平衡,加入Na2CO3固体,Ca2++CO32-=CaCO3↓,溶解平衡右移,使氢氧化钙减少.
Ca2++2OH-平衡,加入Na2CO3固体,Ca2++CO32-=CaCO3↓,溶解平衡右移,使氢氧化钙减少.
13.(1)O.005mol·L-1·S-1 (2)大于、小于、大于 (3)B
![]()
![]()
14. (1)由Fe(s)+H20(g)![]() FeO(s)+H2(g)达化学平衡状态时n(H2)/n[H2O(g)]=1.49 ,易知在平衡体系中每生成l mol H2,在平衡气体混和物中必须有
FeO(s)+H2(g)达化学平衡状态时n(H2)/n[H2O(g)]=1.49 ,易知在平衡体系中每生成l mol H2,在平衡气体混和物中必须有
存在才能维持上述化学平衡状态,要维持气相中n[H20(g)]=O.67 mol;故必须通人1.67 mol H20(g)才能产生1.00 mol H2
(2)
Fe(s) + H20(g)![]() FeO(s)+H2(g)
FeO(s)+H2(g)
起始:0.80 1.00 0 0
平衡:0.80-x 1.00-x x x
![]()
![]() 由平衡时
,故
由平衡时
,故
x=0.600mol,平衡时:n(Fe)=0.80mol- 0.60mol=0.200mol
n(H20)=1.00mol-0.60mol=0.400mol
n(FeO)=0.60mol n(H2)=0.600mol。