高中化学第三册1~3单元综合测试题
(时间:90min 总分:100分)
一、单项选择题(每小题只有一个正确选项):包括5个小题,每小题2分,共10分。
1.下列晶体中,不属于原子晶体的是 ( )
A.干冰 B.水晶 C.晶体硅 D.金刚石
2.一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3——HNO3+N2+H2O,在此反应中被氧化与被还原的氮原子数之比为 ( )
A. 5:3 B.5:4 C.1:1 D. 3:5
3.已知如下两个热化学方程式:
2CO(g)+O2(g)===2CO(g);△H==-566kJ/mol CH4(g)+2O2(g)==CO2(g)+2H2O(1);△H=-890kJ/mol 由1molCO 和3molCH4组成的混合气在上述条件下完全燃烧时,释放的热量为 ( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
4.向50mLl8mo1.L-1H2SO4溶液中加入足量的Cu片并加热。充分反应后,被还原的H2SO4的物质的量为 ( )
A.小于0.45mol B.等于0.45mol
C.在0.45mol和0.90mol之间 D.大于0.90mol
5.下列各组离子中,因发生氧化还原反应而不能大量共存的是 ( )
A.H+、Na+、S2O32-、Cl- B.Fe3+、Fe2+、SO42-、NO3-
C.Na+、OH-、SO42-、H2PO4- D.Cu2+、Na+、S2-、SO42-
二、多项选择题(每小题有1~2个选项符合题意):包括14个小题,每小题3分,共42分。
6.FeCl3溶液和Fe(OH)3胶体具有的共同性质是 ( )
A.滴人盐酸,先产生沉淀,然后沉淀又溶解 B.都能透过半透膜
C.都有丁达尔现象 D.加热蒸干灼烧,最终都有Fe2O3生成
7.根据反应(1)~(4),可以判断下列四种物质的氧化性由强到弱的正确顺序是 ( )
(1)Cl2+2KI===2KCl+I2 (2)2FeCl2+Cl2===2FeCl3
(3)2FeCl3+2HI===2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>H2S
C.Fe3+>Cl2>H2S>I2 D.Cl2>I2>Fe3+>H2S
8.R2O8n-离子在一定条件下可以把Mn2+离子氧化成MnO4-,若反应后R2O8n-离子变为RO42-离子。 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
( )
A.1 B. 2 C.3 D.4
9.下列各反应离子方程式错误的是 ( )
A.将Cl2通人FeCl2溶液中:Cl2+2Fe2+===2Fe3++2Cl-
B.硫代硫酸钠溶液滴加稀H2SO4变浑浊:S2O32-+2H+=SO2↑+S↓+H2O
C.少量钠投入CuSO4溶液中:2Na+Cu2++2H2O===Cu(OH)2↓+2Na++H2↑
D.氯气通人溴化亚铁溶液中:Cl2+2Br-+2Fe2+===2Fe3++Br2+2Cl-
10.欲配制下列各组离子的溶液,能够实现的是 ( )
A.Cu2+、Br-、HCO3-、A1O2- B.Fe3+、K+、SCN-、SO42-
C.Fe2+、NO3-、HSO3-、Ag+ D.Na+、AlO2-、K+、C6H5O-
11.在透明的酸性溶液中,能大量共存的离子组是 ( )
A.Mg2+、CO32-、HCO3-、NO3- B.Na+、CH3COO-、HCO3-、Cl-
C.Fe3+、CO32-、OH-、SO42- D.NH4+、Cl-、Cu2+、SO42-
12.只能表示一个化学反应的的离子方程式为 ( )
A.Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
B.CO32-+2H+===H2O+CO2↑
C.2Br-+Cl2===2C1-+Br2
D.SO2+Cl2+2H2O===4H++2Cl-+SO42-
13.被称为万能还原剂的NaBH4,溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑。下列说法正确的是 ( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,水是还原剂
C.硼元素被氧化,氢元素被还原 D.氢气既是氧化产物又是还原产物
14.下列说法正确的是 ( )
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,因为分子晶体中有化学键
C.金属在常温下都以晶体形成存在
D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用
15.不能用来说明金属X比金属Y还原性强的是 ( )
A.把X-Y合金置于潮湿空气中,X先腐蚀
B.X原子最外层电子数比Y原子最外层电子数少
C.X能从Y的盐溶液中把Y置换出来
D.X的氢氧化物比Y的氢氧化物的碱性强
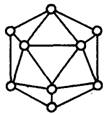 16.晶体硼的基本结构单元都是由硼原子组成的正二十面体的 原子晶体(如右图)。其中含20个等边三角形和一定数量的顶角,每个顶角上各有一个原子。试观察推断这个基本结构单元所含B原子数,B—B键个数及键角正确的一组是( )
16.晶体硼的基本结构单元都是由硼原子组成的正二十面体的 原子晶体(如右图)。其中含20个等边三角形和一定数量的顶角,每个顶角上各有一个原子。试观察推断这个基本结构单元所含B原子数,B—B键个数及键角正确的一组是( )
A.20个,60个,360° B.12个,30个,60°
C.9个,18个,45° D.18个,54个,90°
17.已知如下两个热化学方程式
C(s)+O2(g)===CO2(g);△H==-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H===-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是 ( )
A.1:1 R l:2 C.2:3 D.3:2
18.1993年报导,合成了迄今为止世界上最大的烃,即C1134H1146。下列有关叙述正确的是 ( )
A.具有高硬度 B.属于高分子化合物
C.属于分子晶体 D.常温下呈固体
19.下列事实与胶体性质无关的是 ( )
A.在豆浆里加入盐卤做豆腐
B.河流人海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
高中化学第三册1~3单元综合测试题
_____班,学生____________ 得分___________
1~19题答案表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 27 | 18 | 19 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、填空题:包括4小题,共34分。
20.(9分)(1)SiO2晶体中,1个Si原子可与______个O原子形成共价键。
(2)右图为石墨的晶体结构俯视图。在石墨晶体中C原子数与C—C键数之比为___。
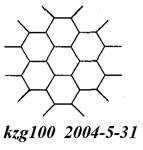 (3)C100H120为含多个C≡C的链状化合物的分子式,该分 子中含C≡C最多有______个。
(3)C100H120为含多个C≡C的链状化合物的分子式,该分 子中含C≡C最多有______个。
21.(6分)在一定条件下,RO3n-和I-可以发生反应,离子方 程式如下:
RO3n-+6I-+6H+===R-+3I2+3H2O
(1)RO3n-中R元素的化合价为________
(2)R元素的原子核外最外层电子数为________个。
22.(6分)I2与S2O32-反应,产物之一为S4O62-。请写出并配平该反应的离子方程式_ _________________________,此反应既快又安全,常用作化学定量分析,但一般要在接近中性条件下进行。请用离子方程式解释其原因_______________________。
__________________________________。
23.(13分)某河道两旁的甲、乙两工厂。它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-和NO3-六种 离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是___________________。
(2)乙厂的废水中含有另外三种离子。现有活性炭、硫酸亚铁、铁粉,如果加入其中的_________就可以回收金属_________;
(3)若使甲、乙两厂的废水按适当比例混合,可以使废水中的_________离子转化为沉淀,经过滤后的废水主要含有____________,可以用来浇灌农田。
四、综合计算:包括1小题,共14分。
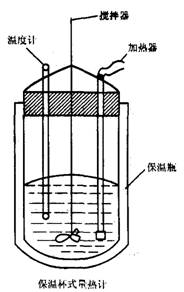 24.(14分)在量热计中(见下图),将100cm3、0.500mol.L-1CH3COOH溶液与100cm3、0.500mol.L-1 NaOH溶液混合,温度从298.16K升高到300.71K,已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150.5J·K-1,0.250mol·L-1,CHaCOONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0.963g·cm-3。
24.(14分)在量热计中(见下图),将100cm3、0.500mol.L-1CH3COOH溶液与100cm3、0.500mol.L-1 NaOH溶液混合,温度从298.16K升高到300.71K,已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150.5J·K-1,0.250mol·L-1,CHaCOONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0.963g·cm-3。
(1)试求CH3COOH的中和热(中和反应生成1mol 水时放出的热量)
(2)CH3COOH中和热的文献值为56.1kJ·mol-1, 你认为(1)中测得的实验值偏差可能是什么原因造成的?
(3)你认为CH3COOH的中和热与HCl的中和热相比,哪个大?为什么?
1~4单元综合测试题答案
1.A
2.A
3.B 分析:根据热化学方程式中,反应热与各物质的计量数的对应关系,得共释放的热量为:566kJ/mol×mol+890kJ/mol×3mol=2953kJ
4.A 分析:因反应中被还原的H2SO4为反应硫酸的物质的量的一半,即×18mol·L-1×0.05L==0.45mol;但是随反应进行,硫酸浓度变稀,则实际反应的H2SO4比所给要少,故选A
5.B
6.D
分析:A项,滴入盐酸,FeCl3溶液无现象;B项,FCl3溶液能透过半透膜,而Fe(OH)3胶体不能透过,C项,FeCl3溶液无丁达尔现象,D项中蒸发FeCl3溶液,促进水解,产生Fe(OH)3,同时HCl挥发,蒸干,灼热2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
7.B 分析:在同一氧化还原反应中,氧化性:氧化剂>氧化产物。由(1)知Cl2>I2 (2)知Cl2>Fe3+ (3)知Fe3+>I2 (4)知I2>S 综合分析:氧化性由强到弱的顺序为:Cl2>Fe3+>I2>S 故选(B)
8.B
9.D 分析:D中n(Cl2)不足,则离子方程式为2Fe2++Cl2===2Fe3++2Cl-;n(Cl2)过量,则离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
10.D 分析:A中Cu2+与HCO3-、AlO2-会发生双水解而不能共存,B中Fe3+与
11.D 分析:A中CO32-、HCO3-在酸性溶液中会生成CO2、H2O而不能存在,有
CO32-、HCO3-的B、C选项不可选
12.AD分析:B项,所有可溶性碳酸盐如Na2CO3,K2CO3等与强酸,如HCl、H2SO4、HNO3等反应都可用此式表示;C项:如KBr、NaBr与Cl2的反应
13.D 分析:
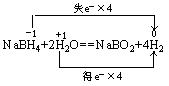
14.D 分析:A项,如NH4Cl中既有有离子键,又有共价键,B项分子晶体的熔点低,是因为只需克服较弱的范德华力,C项Hg在常温下是以液态形式存在。故选D。
15.B 16.B 17.A 18.CD
19.A
分析:根据胶体的性质分析判断;A:豆浆是属植物蛋白质胶体,加入的盐卤属电解质,电解质所生成的离子所带的电荷中和了胶体粒子吸附的电荷,发生凝聚;B:土壤胶体遇海水中的电解质发生凝聚,C:胶体溶液具有丁达尔现象;D:这是化学反应而不是属于胶体的性质,即Fe3++3OH-=Fe(OH)3↓
20.(1)4 (2)2:3 (3)20
21.(1)+5 (2)7
分析:根据电荷守恒,可知n=1,则RO3-中R为+5价,最外层电子数=8-负化合价=7
22.I2+2S2O32-===S4O62-+2I- 在酸性条件下会发生S2O32-+2H+=S↓+SO2↑+H2O反应,碱性条件下会发生I2+2OH-===I-+IO-+H2O反应
23.(1)K+、OH-、Cl- (2)铁 Ag (3)Fe3+、Ag+、Cl-、OH-;KNO3
24.分析:CH3COOH与NaOH溶液反应所放出的热量应等于量热计和反应后溶液升高温度所吸收的热量。量热计吸收的热量:Q1==C1△T,反应后溶液吸收热量:Q2=C2m△T==C2ρV△T,上两式△T是温度升高值,Cl-热容常数、C2-溶液比热容,ρ是溶液密度,V是溶液体积
答:(1)CH3COOH与NaOH溶液反应放出的总热量:Q==4.03J·g-1k-1×200cm3×0.963g·cm-3×(300.71-298.16)k+150.5J·k-1×(300.71—298.16)k=2363J=2.363kJ;
CH3COOH的中和热为:==47.3kJ·mol-1
(2)实验值比文献值小,出现这种原因可能是量热计的保温瓶绝热效果不好,使部分热量散失,也可能是温度计测温不够精确所致。
(3)CH3COOH的中和热比HCl的中和热小,因为弱酸CH3COOH电离出H+的过程需吸收热量。