高中化学总复习单元测试题(一)
第一单元 化学反应及其能量变化
姓名_______________ 班级______ 分数_________
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Cl 35.5 K 39 Fe 56 Cu 64 Zn 65
一、选择题(每小题只有一个选项符合要求,每小题6分,共54分,请将符合要求的选项填入括号内)
1. 对于反应:H-+ NH3 =H2 + NH2-的正确说法是 ( )
A.属于置换反应 B. H-是氧化剂 C. NH3是还原剂 D. H2既是氧化产物又是还原产物
2. 已知Cu+2Fe3+=Cu2++2Fe2+,Zn+2Fe3+=Zn2++2Fe2+,现将等物质的量的CuSO4、FeCl3和Zn置于水中充分反应后,反应器中所得混合物除SO42-和Cl-外,还含有 ( )
A. Zn2+、Cu、Fe2+ B. Zn2+、Cu2+、Fe、Fe2+
C. Zn2+、Cu2+、Fe2+ D. Zn2+、Cu2+、Cu、Fe2+
3. 已知I-、Fe2+、SO2、Cl-、H2O2都有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是 ( )
A. 2Fe3++SO2+2H2O =2Fe2++SO42-+4H+ B. I2+SO2+2H2O= H2SO4+2HI
C. SO2+O2+2H2O=H2O2+H2SO4 D. 2Fe2++I2= 2Fe3++2I-
4. 根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序正确的是 ( )
①![]() ②
②![]() ③
③![]()
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
5. R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-离子,若反应后R2O8n-离子变成RO42-,又知反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n为 ( )
A. 1 B. 2 C. 3 D. 4
6. 下列各组离子中,能在水溶液中大量共存,加入H+呈明显酸性时有沉淀生成的离子组是( )
A. Na+、K+、SO42-、SO32- B. K+、Na+、S2-、SO32-
C. Mg2+、Al3+、SO42-、AlO2- D. Ca2+、Fe2+、Cl-、NO3-
7. 在pH=1的无色透明溶液中,不能大量共存的离子组是 ( )
A.Fe3+、I-、SO42-、ClO- B. Al3+、I-、SO42-、ClO-
C.Cu2+、K+、S2-、Cl- D.Zn2+、Na+、NO3-、SO42-
8.下列离子方程式书写正确的是 ( )
A. Na2S水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
C.标准状况下2.24L CO2通入1mol/L 100mL NaOH溶液中:CO2+OH-==HCO3-
D.等物质的量的NH4HCO3与NaOH在溶液中反应: NH4++HCO3-+2OH-==NH3↑+2H2O
9.下列离子方程式的书写正确的是 ( )
A.二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2- ==Al(OH)3↓+HCO3-
B.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH- ==SO32-+NH3↑+2H2O
C.氯气通入冷的烧碱溶液中:2Cl2+2OH- ==3Cl-+ClO-+H2O
D.硫酸氢钠溶液中加入碳酸氢钠溶液:HSO4-+HCO3- ==CO2↑+H2O+SO42-
二、非选择题(包括4个小题,共61分)
10. (12分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧化中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ: 2KClO3
+ 2MnO2 ![]() 2A + B↑+ C↑ Ⅱ: 2A
2A + B↑+ C↑ Ⅱ: 2A ![]() D + MnO2
+ C↑
D + MnO2
+ C↑
Ⅲ: B + D ![]() 2KCl + + C↑
2KCl + + C↑
(1)反应Ⅰ中氧化产物是(填化学式) 。
(2)反应Ⅲ的化学方程式为 。
(3)按上述反应过程,若制取1.5mol氧气,总共有 mol电子发生转移。
11. (15分)(1)在淀粉碘化钾溶液中,滴入少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为 ,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中,滴加亚硫酸溶液,发现蓝色逐渐消失,这是因为
,反应的离子方程式是 。
(3)对比(1)和(2)实验所得,将I2、ClO-、SO42-按氧化性由强到弱的顺序排列为 。
12.(12分)(1)24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度为0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 。
(2)某电解质溶液中,可能大量存在有Ag+、H+、Cu2+、CO32-、OH-、Cl-离子,你认为一定有的离子是______,一定没有的离子是 ;还需要进一步确认的离子是_______,怎样判断有无
。
13.(22分)如图所示一氧化碳还原铁的氧化物的实验装置,回答下列问题。

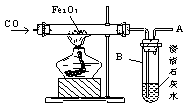
(1)硬质玻璃管右端出来的气体是_____________________。
(2)反应过程中硬质玻璃管发生的现象是_________________________________________。
(3)该反应中电子转移数目为________________。
(4)实验开始时应先通入一段时间的CO,是为了______________________________________。
(5)在A处排出的气体是_______________,如何进行除去尾气?_______________。
(6)写出实验室制取CO的化学方程式________________________________________,利用了________的__________性。
(7)在上面方框内,试用简图画出CO的发生装置,并标明试剂。
 |
第一单元 化学反应及其能量变化 参考答案
1. D 2. D 3. D 4. D 5. B 6. B 7. B 8. C 9. A
10. ⑴
KMnO4 、O2 ⑵ Cl2+K2MnO4![]() 2KCl+MnO2+O2↑ ⑶ 6
2KCl+MnO2+O2↑ ⑶ 6
11. ⑴ I-被ClO-氧化为I2,遇淀粉变蓝, 2H++ClO-+2I-![]() H2O+I2+Cl-(或H2O+ClO-+2I-
H2O+I2+Cl-(或H2O+ClO-+2I-![]() 2OH-+I2+Cl-)
2OH-+I2+Cl-)
⑵ I2和SO32-反应生成I-, H2O+I2+H2SO3![]() 4H++SO42-+2I-
4H++SO42-+2I-
⑶ ClO->I->SO42-
12. ⑴ +3 ⑵Cl-;Ag+、CO32-、OH-;H+、Cu2+;观察溶液颜色,如为蓝色则有Cu2+;加足量铁粉,有气泡产生,则有H+。(其它答案合情合理亦可)
13. ⑴ 生成的CO2以及未反应的CO ⑵ 管内固体由红色变为黑色 ⑶ 6e-
⑷ 为了排尽装置内的空气 ⑸ CO和H2O(g) 点燃
⑹ HCOOH ![]() H2O+CO↑ 浓H2SO4 脱水
H2O+CO↑ 浓H2SO4 脱水
⑺
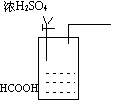 |