高三化学总复习(元素化合物)
氯气(共两课时)
复习目标:
1、 掌握氯气的分子结构物理性质和化学性质;
2、 掌握氯气的制法及制备装置的特点,区别液氯、新制氯水、久置氯水的成分;
3、 HClO的性质(强氧化性、不稳定性、弱酸性)的证明及漂白粉制取原理、有效成分,使用原理。
基本知识:
1、 氯气的物理性质:黄绿色――鉴别时切入点
有刺激性气味、有毒――注意闻味方法,防毒方法
易液化、能溶于水、密度大于空气――如何收集?
2、氯气的化学性质:
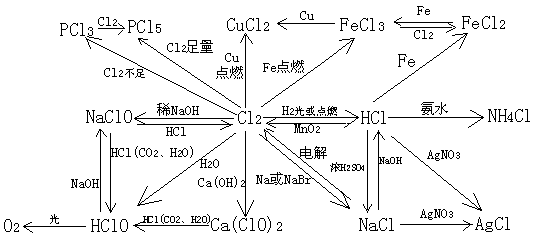
l 氯气能将金属氧化到最高价态;
l 铜在氯气中燃烧产生棕黄色烟,加水后溶液呈蓝绿色;
l 氢气和氯气反应产生苍白色火焰,光照氢气和氯气混合气发生爆炸;
l 2Cl2+2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O——工业生产漂白粉的原理;
漂白粉的主要成分:CaCl2 、 Ca(ClO)2 ;有效成分: Ca(ClO)2
![]() 漂白原理:CO2 +H2O+
Ca(ClO)2== CaCO3+2HClO
漂白原理:CO2 +H2O+
Ca(ClO)2== CaCO3+2HClO
漂白粉失效:2HClO = 2HCl +O2↑
3、氯气的实验室制法:
原理:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2 ↑ + 2H2O
MnCl2 + Cl2 ↑ + 2H2O
(2KMnO4 + 16HCl == 2MnCl2 + 5Cl2 ↑ + 2KCl +8H2O)
(KClO3 + 6HCl(浓)== KCl + 3Cl2 ↑ + 3H2O)
(Ca(ClO)2 + 4HCl == CaCl2 + 2Cl2 ↑ + 2H2O)
装置:固+液
![]() 气体
分液漏斗、圆底烧瓶、酒精灯、双孔塞、导气管
气体
分液漏斗、圆底烧瓶、酒精灯、双孔塞、导气管
除杂:饱和食盐水除氯化氢(什么原理?)――浓硫酸除水蒸气
收集:向上排气法或排饱和食盐水
尾气处理:碱液吸收(NaOH或Ca(OH)2)
验满方法:湿润的碘化钾淀粉试纸放在瓶口,看是否变蓝
4、氯水的成分:
![]()
![]() 三种分子:H2O、Cl2、HClO、(O2) ;浅黄绿色,强氧化性,
三种分子:H2O、Cl2、HClO、(O2) ;浅黄绿色,强氧化性,
新制氯水 四种离子:H+、Cl—、ClO—、OH—;漂白性,酸性
久置氯水:H2O 、H+ 、Cl— 、OH- ——无色,酸性,无强氧化性和漂白性
有关反应:
①碳酸钠溶液中加入氯水:2H+ + CO32—= H2O+ CO2↑
②氯水杀菌消毒:HClO的强氧化性
③氯水中加入AgNO3 :Cl—+Ag+ ==AgCl↓
④溴化钾溶液中加入氯水:Cl2+ 2KBr==2KCl+Br2
⑤氯水中加入石蕊试剂:先变红后褪色
⑥氯水中加入镁粉:Mg + Cl2 = MgCl2 氯水颜色褪去
Mg + 2H+ = Mg2++ H2↑ 有气泡产生
⑦氯水与还原性物质反应:Cl2 + 2FeCl2 = 2FeCl3 溶液由浅绿色变为棕黄色
Cl2 + Na2SO3 + H2O = Na2SO4 + 2HCl
5、氯离子的检验:硝酸酸化的硝酸银以排除CO32— 、HCO3—等的干扰
题型与变式
1、常用氯气来给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是 ( D )
A、石蕊试剂 B、硝酸银 C、亚硫酸钠 D、氯化铝
2、8.7g MnO2与含14.6gHCl的浓盐酸共热可生成氯气的质量为 ( D )
A、等于14.2g B、等于7.1g C、7.1g—14.2g之间 D、小于7.1g
3、滴加新制氯水无单质生成的是 ( B )
A、KI溶液 B、硝酸银溶液 C、Na2S溶液 D、FeBr2溶液
4、 用滴管将新制的饱和氯水,逐滴滴入含有酚酞的氢氧化钠稀溶液中,边滴边振荡,直
至红色刚好褪去。褪色的原因可能有两种,请用简要的文字说明:
(1)①是 ;②是 ;
(2)请设计简单的实验证明红色褪去的原因是①或②原因简述所用试剂、操作现象及结论 。
5、浓盐酸与次氯酸钙能发生如下反应:Ca(ClO)2 + 4HCl == CaCl2 + 2Cl2 ↑ + 2H2O,
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是: ( A )① CO2 ② HCl ③ H2O ④ O2
A、①②③ B、②③④ C、②③ D、①④
6、向溴化亚铁溶液中通入Cl2时,写出它们的离子方程式:
(1)Cl2少量时: ;
(2)Cl2过量时: 。
7、氯化碘(ICl)的化学性质跟氯气跟氯气相似,预计它跟水反应的最初生成物是:(B)
A、HI和HClO B、HCl和HIO C、HClO3 和HIO D、HClO和HIO
8、今有甲、乙、丙三瓶等体积的新制氯水浓度均为0.1mol/L。如果在甲瓶中加入少量的Na2CO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲乙丙三瓶溶液中HCIO的物质的量浓度的大小关系是(溶液体积变化忽略不计) (B)
A、甲=乙>丙 B、甲>丙>乙 C、丙>甲=乙 D、乙>丙>甲
简述选择的理由: 。
9、检验氯化氢气体中是否混有氯气,可采取的方法是 (D)
A、用干燥的蓝色石蕊试纸 B、用干燥的有色布条
C、将气体通入硝酸银溶液 D、用湿润的淀粉碘化钾试纸
10、下列物质中,不含自由移动的氯离子的是 ( )
A、熔融氯化钾 B、液态氯化氢 C、氯水 D、氯化钠溶液
11、市场上销售的“84”消毒液,其商品标识上注明:(1)本品为无色液体呈碱性(2)使用时应加水稀释(3)可对餐具、衣物进行消毒,可漂白浅色衣物,则其有效成分可能是:( )
A、Cl2 B、SO2 C、NaClO D、KMnO4
12、下列关于漂白粉的叙述中,正确的是 ( )
A、漂白粉的有效成分是Ca(ClO)2 和CaCl2 B、漂白粉在空气中久置后能变质
C、漂白粉的溶液呈中性 D、在使用漂白粉时应用浓盐酸
13、往某酸溶液中通入过量Cl2,再滴加Ba(NO3)2溶液和稀HNO3溶液有白色沉淀,则某盐可能是①AgNO3 ②Na2CO3 ③Na2SO3 ④NaNO3 ( )
A、①③ B、③ C、① D、①②③
14、要使新制氯水中增大次氯酸的浓度,下列措施中不合理的是 ( )
A、加少量AgNO3 晶体 B、加少量NaHCO3粉末
C、加过量CaO D、加少量CaCO3
15、下列对氯气的描述中,不正确的是 ( )
A、在标准状况下,氯气的密度是3.17g/L B、实验室不能用排水法收集氯气
C、液氯不导电,是非电解质;氯水能导电,是电解质
D、不干燥的氯气遇二氧化硫,其漂白性能减弱
16、造纸工业中,常用Cl2漂白纸浆,漂白后的纸浆用NaHSO3除去残留的Cl2,其反应为:
Cl2+ NaHSO3+ H2O——NaCl + H2SO4 + HCl在这个反应中,氧化产物与还原产物的物质的量之比为 ( )
A、2:3 B、1:1 C、2:1 D、1:2
17、将0.2molMnO2和50mL12mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发) ( )
A、等于0.2mol B、小于0.2mol
C、大于0.2mol小于0.6mol D、以上结论都不正确
18、以食盐为基本原料的化学工业除用来制烧碱、盐酸外还能制得 ①漂白精②聚乙烯③聚氯乙烯④氯化铁⑤烧碱 ( )
A、全部 B、①③④⑤ C、只有①④⑤ D、只能②③
10、实验室用浓盐酸、MnO2共热制氯气,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:2Cl2+2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 == 5CaCl2 + Ca(ClO3)2 + 6H2O现有3个同学分别设计的3套实验装置如下:
(1)请从a.不容易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.污染环境 f.可防止污染环境。几个方面对上述甲乙丙3套装置的优缺点作出评价,并选择符合题目要求的选项的序号填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ① | ② |
| 乙装置 | ③ | ④ |
| 丙装置 | ⑤ | ⑥ |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E 3部分组成,丙由F、G 2部分组成。请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是 。较完善的装置中还缺少的装置是 。原因是 。
(3)实验中若用12mol/L的盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是 0.15mol(填大于、小于或等于)。其原因是(假定各步反应均无反应物损耗,且无副反应发生) 。