高三教学质量检测化学试题3
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共100分,考试时间90分钟。
第I卷(选择题,共46分)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 K 39
Ca 40 Cu 64
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意。)
1.下列有关化学反应热的说法中,不正确的是 ( )
①放热的反应发生时不必加热
②化学反应一定伴随有能量变化
③一般地,吸热反应需要加热后才能发生
④化学反应热效应数值与参加反应物质的多少有关
A.①② B.②③ C.①③ D.②④
2.NH2Cl是一种强力杀菌剂,它加入水中则发生水解反应,其产物有 ( )
①NH2Cl ②HCl ③NH2OH ④NH3 ⑤HClO
A.②③ B.①② C.②④ D.④⑤
3.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
4.在一定温度和压强下,阿伏加德罗定律成立的根本原因是 ( )
A.气体所占体积的大小只随气体分子数的多少而变化
B.不同种气体分子的大小几乎相等
C.不同种气体分子间的平均距离几乎相等
D.气体分子间的平均距离与分子本身的大小成正比
5.下列有关碱金属铷的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰没有特殊颜色
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是一种弱碱
6.下列离子方程式中,正确的是 ( )
A.实验室用浓盐酸与二氧化锰制取氯气
4HCl(浓)+MnO2 △ Mn2+ +2Cl- +2H2O+Cl2↑
B.氯气通入冷的氢氧化钠溶液中
2Cl2+2OH-=3Cl-+ClO-+H2O
C.钠跟水反应
2Na+2H2O=2Na++2OH-+H2↑
D.漂粉精溶液中通入过量的二氧化碳
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
7.NA代表阿伏加德罗常数值,下列说法正确的是 ( )
A.9g重水所含有的电子数为5NA
B.1molMgCl2中含有的离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中含有的共价键总数为31NA
8.已知(1)H2(g)+![]() O2(g)=H2O(g); △H1=akJ·mol-1
O2(g)=H2O(g); △H1=akJ·mol-1
(2)2H2(g)+ O2(g)=2H2O(g); △H2=bkJ·mol-1
(3)H2(g)+![]() O2(g)=H2O(1); △H3=ckJ·mol-1
O2(g)=H2O(1); △H3=ckJ·mol-1
(4)2H2(g)+ O2(g)=2H2O(1); △H4=dkJ·mol-1
下列关系式中正确的是 ( )
A.2a=b<0 B.a<c<0 C.b>d>0 D.2c=d>0
二、选择题(本题包括10小题,每小题3分,共30分。每小题有只有一个选项符合题意)
9.在一定温度下,某无水盐R在不中的溶解度为23g,向R的饱和溶液中加入Bg该无水盐,
保持温度不变,析出R的结晶不合物为Wg,则从原饱和溶液中析出溶质R的质量为( )
A.(W-B)×![]() g B.(W-B)
g B.(W-B)![]() g
g
C.(W-B)×![]() g D.(W-
g D.(W-![]() B)g
B)g
10.下列措施都是为了提高中和热测定的准确性,其中是为了使反应进行完全的是( )
①在两个烧杯之间填充碎泡沫塑料 ②用泡沫塑料板作盖板
③用环形玻璃棒搅动溶液 ④实验重复两次
⑤使用过量的碱
A.①② B.①②④ C.③⑤ D.①②③④⑤
11.已知某溶液中存在较多的H+、SO42-和NO3-,则该溶液中还可能大量存在的离子组是
( )
A.Mg2+、Ba2+、Br- B.Al3+、CH3COO-、Cl-
C.Mg2+、Cl-、I- D.Na+、NH4+、Cl-
12.体积为V,密度为ρ的某溶液中,含有摩尔质量为M的溶质的质量是m。若此溶液中溶质的物质的量浓度为c,溶质的质量分数为ω,则下列各表示式中,正确的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
13.下列实验操作中,错误的是 ( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加一定量的水搅拌溶解
B.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
C.配制0.1mol/L的NaOH溶液时,将溶解NaOH的烧杯洗涤2—3次,并将洗涤液转
入容量瓶中
D.配制0.1mol/L的HCl溶液时,最后用胶头滴管加水至刻度线
14.取a g某物质A在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加了b g 。若b>a,则A为 ( )
A.H2 B.CO C.C12H22O11 D.C6H12O6
|
A.O22-离子的电子式为
B.过氧化钡的化学式为Ba2O2
C.1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气
D.过氧化钠或过氧化钡都是强氧化剂
16.有四种含有下列杂质的纯碱样品,当含杂质的质量分数相同时,取等质量的四种样品与浓度相同的盐酸反应,所消耗的盐酸体积由多到少的顺序是 ( )
杂质:①NaOH ②Ca(OH)2 ③NaHCO3 ④CaCO3
A.①>②>④>③ B.③>④>①>②
C.②>①>④>③ D.④>③>②>①
17.亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存约1年。但在酸性溶液中因生成亚氯酸而发生分解:5HClO2=4ClO2+H++Cl-+2H2O分解时,刚加入硫酸反应缓慢,随后突然反应迅速,释放出气态的二氧化氯,这是因为 ( )
A.酸使亚氯酸的氧化性增强 B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用 D.逸出ClO2使反应的生成物浓度降低
![]() 18.氯水的成分中含Cl2、、HCl、HClO,在与其它物质反应时,有时以Cl2为主,有时以HCl、HClO为主,然后Cl2+H2O HCl+HClO平衡发生移动。则新制氯水与下列溶液的反应中属于前者的是 ( )
18.氯水的成分中含Cl2、、HCl、HClO,在与其它物质反应时,有时以Cl2为主,有时以HCl、HClO为主,然后Cl2+H2O HCl+HClO平衡发生移动。则新制氯水与下列溶液的反应中属于前者的是 ( )
①NaHS ②NaOH ③KI ④AgNO3
A.①④ B.①②③ C.①② D.①③
第Ⅱ卷(选择题,共54分)
三、(本题包括2小题,共15分)
19.(3分)用托盘天平和小烧杯称量一角匙NaOH的质量,正确的操作顺序为(填序号,可重复) 。
A.调整零点,使指针静止时处于标尺中间B.将游码拨到刻度尺的零处
C.取NaOH放烧杯中称量 D.称量小烧杯的质量
E.将砝码放回砝码盒内 F.记录称量结果
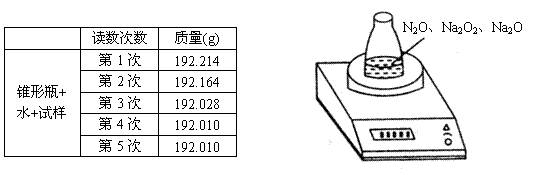 20.(12分)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g,锥形瓶和水的质量为190.720g),利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
20.(12分)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g,锥形瓶和水的质量为190.720g),利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2与H2O反应的化学方程式 。
(2)计算过氧化钠质量分数时,必需的数据是 、 、
。
|
操作I:将样品加入稀盐酸中 → 溶液转移 → 操作II → 称量
①操作II的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要 、
(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填“偏大”“偏小”或“不变)。
四、(本题包括4小题,共24分)
21.(3分)在101kPa, 1.00gC6H6(1)燃烧生成CO2和H2O(1),放出41.8kJ的热量,请写出表示C6H6(1)燃烧热的热化学方程式:
22.(7分)某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是 。
(2)若该反应方程式是I2和KIO3的化学计量数都是5,则KMnO4的化学计量数是 。请在下面的化学式上标出电子转移的方向和数目。
KMnO4+KI+H2SO4→
(3)若不限定某些物质的计量数,可能配平的化学计量数有许我组,原因是
。
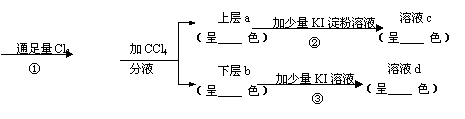 23.(8分)按下面的实验过程填空
23.(8分)按下面的实验过程填空
浅绿色FeBr2溶液 黄色液体
(1)在图表中填上相应的内容。
(2)写出反应的化学方程式:
①
②
24.(6分)有一澄清溶液,其中只可能含有下列离子:H+、K+、Na+、Mg2+、Ba2+、NH4+、Al3+、Fe3+、SO42-、CO32-、Cl-、I-中的某几种,进行如下实验:
(1)用pH试纸检验,试纸呈深红色。
(2)取部分溶液加入少量氯水后分成两份,其中一份加入少许CCl4,振荡、静置后液体分层,下层呈黄绿色;向另一份中加入AgNO3溶液,发现有白色沉淀生成。
(3)另取部分溶液,逐滴加入NaOH溶液至过量,在滴加过程中未发现有沉淀生成。
(4)取(3)所得碱性溶液,加入Na2CO3溶液,有白色沉淀生成,取上层清液进行焰色反应,火焰呈黄色。
(5)取(3)所得的碱性溶液,加热,有气体产生,该气体能使湿润的红色石蕊试纸变蓝色。据以上判断,该溶液中肯定含有 离子, 离子不能肯定 否存在。
五、(本题包括2小题,共15分)
25.(6分)K2CO3、KHCO3混合粉末mg,加热到质量不再减少为止,剩余物质的质量为ng,则:
(1)混合物K2CO3的质量为 g。
(2)题干条件中n的数值应满足的范围是 。
(3)若将加热前的该混和粉末与足量盐酸反应,将所得溶液蒸干,可得KCl固体的质量为 g。
26.(9分)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2 (x、y为正整数且x≤2 ,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用盐酸的物质的量与生成CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;
石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO20g,试通过计算确定该混合物中孔雀石和石表的物质的量之比。
高三教学质量检测
化学试题参考答案
第I卷(选择题,共46分)
一、(2分×8分=16分)
1.C 2.D 3.D 4.C 5.B 6.C 7.D 8.A
二、(3分×10=30分)
9.A 10.C 11.D 12.A 13.B 14.C 15.B 16.C 17.C 18.D
第II卷(非选择题,共54分)
三、(共15分)
19.(3分)B A D F C F E B(错一处即不得分)
20.(12分)(1)2Na2O2+2H2O====4NaOH+O2↑(2分)
(2)试样质量 锥形瓶加水的质量、锥形瓶总质量已达恒量的读数(用具体数值也可;每空1分,共3分)
(3)①蒸发(2分) ②NaCl的质量(1分) ③烧杯 玻璃棒(2分) ④偏大(2分)
四、(共24分)
|
22.(7分)(1)KMnO4(1分) (2)8 (2分) (2分)
(3)该反应可看作两个氧化还原反应的加和,加和时两个反应的比例可发生变化(2分)
23.(8分)(1)a.棕黄(或黄) b.橙红 c.蓝 d.紫红(每空1分,共4分)
(2)①2FeBr2+3Cl2=2FeCl3+2Br2 ②2FeCl3+2KI=2FeCl2+I2+2KCl(每空2分,共4分)
24.(6分)H-、Ba2+、NH4+、Cl-;K+、Na-(每种离子1分,共6分)
五、(共15分)
25.(6分)(1)![]() (2分) 0.69m<n<m(2分) (3)
(2分) 0.69m<n<m(2分) (3)![]() (2分)
(2分)
26.(9分)(1)孔雀石:CuCO3·Cu(OH)2 石青:2CuCO3·Cu(OH)2(每空2分)
(2)设一份样品中孔雀石的物质的量为n1,石青的物质的量为n2。
则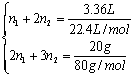 ……(2分)解得
……(2分)解得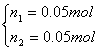 ……(2分)
……(2分)
故![]() ……(1分)
……(1分)