高三年级第四次考试化学试卷
本卷所需相对原子质量: H—1 C—12 N—14 O—16 S—32 K—39 Cl—35.5
Mn—55 Ag—108
一、选择题(每小题只有一个选项符合题意,共48分)
1、下列物质中属于纯净化合物的是( )
A、福尔马林 B、干冰 C、凡士林 D、石墨
|
|
A、Na+ B、![]() C、
C、![]()
![]() D、
D、![]()
3、下列物质中,不含结晶水的是( )
A、芒硝 B、大理石 C、明矾 D、生石膏
4、若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、四、五周期元素分别有( )
A、5种、10种、15种 B、8种、18种、18种
C、8种、10种、15种 D、9种、10种、15种
5、关于物质的量浓度相同的NaCl溶液和NaClO溶液的下列说法中正确的是( )
A、NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等
B、NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度
C、NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度
D、NaCl溶液的pH大于NaClO溶液的pH
6、在常温常压下,向10mL 0.01mol/L FeCl3溶液中滴入1mL 0.01mol/L KSCN溶液,可发生反应FeCl3+3KSN
3KCl+Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移动的条件是( )
A、向溶液中加少量KCl晶体 B、向溶液中加入少量水
C、向溶液中滴入数滴 1mol/L FeCl3 D、设法移走部分水
7、元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外电子数为b;B元素原子的M层电子数为(a-b),L层电子数为a+b,则A,B两元素所形成的化合物的晶体类型为( )
A、分子晶体 B、原子晶体 C、离子晶体 D、金属晶体
8、向一容积不变的密闭容器中充入1mol N2O4,建立了平衡N2O4 2NO2,测知N2O4的转化率为a%,在其它条件不变时再充入1molN2O4的转化率为b%,a与b的大小关系为(
)
A、a<b B、a>b C、a=b D、无法确定
9、下列离子方程式书写正确的是( )
A、FeBr2溶液通入少量Cl2:2Br-+2Cl2==Br2+2Cl-
B、硫化亚铁投入过量的稀硫酸中:S2-+2H+===H2S![]()
C、AgNO3溶液中通入过量氨气:Ag++2NH3 Ag(NH3)![]()
D、含有等物质的量的NH4HSO3与NaOH溶液反应:
NH![]() +HSO
+HSO![]() +2OH-
+2OH- SO![]() +NH3
+NH3![]() +2H2O
+2H2O
10、下列说法中正确的是(设NA表示阿伏加德罗常数)( )
A、通常状况下11.2L CO2含有的分子数为0.5NA
B、常温常压下,16g臭氧含有的氧原子数目为NA
C、标准状况下44.8L SO2与22.4L O2在催化剂作用下反应,一定生成2NA个SO3
D、电解AgNO3溶液析出10.8gAg,电极上转移的电子数为NA
11、在医院中,为酸中毒病人输液不应采用( )
A、0.9%氯化钠溶液 C、0.9%氯化铵溶液
B、1.25%碳酸氢钠溶液 D、5%葡萄糖溶液
12、化学反应3A(g)+B(g)=2C(g)+2D(g)在不同条件下反应,用不同物质表示的该反应速率分别为①V(A)=0.8mol/L·min ②V(B)=0.45mol/L·min ③ V(C)=0.015mol/L·s
④V(D)=0.45mol·min,则在以上不同条件下,该反应速率的大小比较正确的是( )
A、①>②>③>④ B、②=③>①>④
C、②>①>④>③ D、②>①=④>③
13、有一化学平衡mA(g)+nB(g) pC(g)+qD(g)如图:如表示A的转化率与压强、温度的关系,分析图示可以得出的正确结论是( )
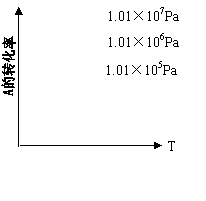 A、正反应是吸热反应且m+n>p+q
A、正反应是吸热反应且m+n>p+q
B、正反应是吸热反应且m+n<p+q
C、正反应是放热反应且m+n>p+q
D、正反应是放热反应且m+n<p+q
14、在25℃时,VmLpH=a的盐酸中,滴加pH=b的NaOH
溶液10VmL时,溶液中Cl-的物质的量恰好等于Na+的物质
的量,则a+b的值是( )
A、13 B、14 C、15 D、无法确定
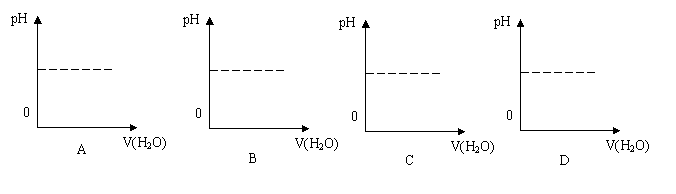 15、能表示人体喝水时,胃液的pH变化的图像是(
)
15、能表示人体喝水时,胃液的pH变化的图像是(
)
|
A、Ag B、Zn(OH)2 C、Ag2O D、Zn
二、填空题(包括4题,共32分)
17、(4分)人们使用很多方法来保存食物,如在粮仓内充入N2,粮食可保存更长时间,这是因为 。也可用冰箱保存食物,这是因为 。
18、(8分)(1)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①0.01mol/LNaOH溶液的pH=
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH=
(2)①已知一溶液有4种离子:X+、![]() 、H+、OH-下列分析结果肯定错误的是(
)。
、H+、OH-下列分析结果肯定错误的是(
)。
A、CY->CX+>CH+>COH- B、CX+>CY->COH->CH+
C、CH+>CY->CX+>COH- D、COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是( )
A、C![]() <CNa+
B、C
<CNa+
B、C![]() > C
> C![]()
C、2CH+= C![]() -C
-C![]() D、C
D、C![]() + C
+ C![]() =0.01mol·L-1
=0.01mol·L-1
19、(12分)两个密闭容器A和B,A容器有一个可移动的活塞使容器保持恒压,B容器保持恒容,起始时向这两容器中分别充入等量的体积比1:3的N2和H2的混合气体,并使A和B的容积相等(如图),恒温下N2(g)+3H2(g) 2NH3(g)
![]() (1)达平衡的时间,A容器比B容器 (长、短、相等),
(1)达平衡的时间,A容器比B容器 (长、短、相等),
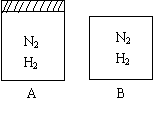 A容器中N2的转化率比B容器中N2的转化率 (高、低、相等)
A容器中N2的转化率比B容器中N2的转化率 (高、低、相等)
(2)达到(1)平衡后,若向两容器中通入数量不多的等量Ar,
A容器中化学平衡向 (正、逆、不)移动,B容器中化学平
衡向 (正、逆、不)移动。
 (3)达到(1)平衡后,若再向容器中通入等量的体积比为1:3的N2和H2的混合气体,达到新的平衡时,A容器中NH3的体积分数 (增大、减小、不变),B容器中NH3的体积分数 (增大、减小、不变)
(3)达到(1)平衡后,若再向容器中通入等量的体积比为1:3的N2和H2的混合气体,达到新的平衡时,A容器中NH3的体积分数 (增大、减小、不变),B容器中NH3的体积分数 (增大、减小、不变)
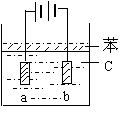
20、(8分)由于Fe(OH)2极易被氧化,用亚铁盐溶液与烧碱溶液反应很难
得到白色纯净的Fe(OH)2沉淀,但用如图所示的电解装置可得纯净
Fe(OH)2沉淀,电极材料分别为石墨和铁。
(1)a电极材料是 ,电极反应式是 。
(2)电解液C可以是 (填编号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)若C为Na2SO4溶液,电解一段时间看到白色Fe(OH)2沉淀后,再反接电源进行电解,电极上看到气泡时,C中出现的明显现象是 。
三、实验题(包括2题,共14分)
21、(6分)有一学生在实验室测某溶液pH,实验时他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测
(1)该学生的操作是 (填“正确”或“错误”)
(2)如不正确请说明理由,同时请分析是否一定有误差,
。
(3)若用此法分别测定CH+相等的盐酸和醋酸溶液的pH,误差较大的是 。
22、(8分)草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验①称取Wg草酸晶体配制100.00mL水溶液 ②取25.00mL所配的草酸溶液置于锥形瓶中,加适量稀H2SO4后,用浓度为a
mol/L的KMnO4溶液滴定,所发生的反应为:KMnO4+H2C2O4+H2SO4![]() K2SO4+CO2
K2SO4+CO2![]() +MnSO4+H2O
+MnSO4+H2O
(1)实验②滴定时,KMnO4溶液应装在 滴定管中。
(2)若滴定过程中,读数时,滴定前仰视,滴定后俯视,则所测得的x值 (偏大、偏小、无影响)
(3)若滴定过程中,共用去a mol·L-1KMnO4溶液VmL,所配制的草酸溶液的物质的量浓度为 。由此可计算出草酸晶体结晶水的x值为 。
四、计算题:(包括1题,6分)
23、(6分)对于可逆反应2A(g)+3B(g) xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应由开始到平衡时间是2min,C的反应速率为0.5 mol·L-1·min-1,平衡时D的浓度为0.5 mol·L-1,回答
(1)x=
(2)B的平衡浓度为
(3)A的转化率为
 高三年级第四次考试化学答卷
高三年级第四次考试化学答卷
一、选择题(16×3分=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | B | C | B | B | B | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | B | C | B | A | A | A | A |
二、(共32分)
17、(4分) 降低O2浓度而降低反应速率 (2分)
降低温度而减慢腐败速率 (2分)
18、(8分)(1)① 11 (2分)② 12 (2分)
(2)① C (2分)② D (2分)
19、(12分)(1) 短 (2分) 高 (2分)
(2) 逆 (2分) 不 (2分)
(3) 不变 (2分) 增大 (2分)
20、(8分)
(1) Fe (2分) Fe-2e- = Fe2+ (2分)
(2) BC (2分)
(3) 白色沉淀迅速变成灰绿色,最终变为红褐色 (2分)
三、实验题(包括2题,共14分)
21、(6分)
(1) 错误 (2分)
(2)若溶液不显中性,则CH+或C OH![]() 被稀释,测得不是原溶液对应的pH,不一定有误差,当溶液为中性,则不产生误差 (2分)
被稀释,测得不是原溶液对应的pH,不一定有误差,当溶液为中性,则不产生误差 (2分)
(3) 盐酸 (2分)
22、(8分)
(1) 酸式 (2分)(2) 偏大 (2分)
(3)
0.1aVmol·L-1 (2分)![]() (2分)
(2分)
四、计算题:(包括1题,6分)
23、(1)x= 2 (2分)
(2)B的平衡浓度为 1.5mol·L-1 (2分)
(3)A的转化率为 20% (2分)