高三年级第四次月考化学试卷
命题人:曹春清 审题人:辛俊玲
可能用到的相对原子质量:C:12 O:16 N:14 H:1 Cu:64 S:32
第一卷(满分45分)
一、 选择题(每小题只有一个正确答案,每小题3分,共45分)
1.某微粒用![]() R
R![]() 表示,下列关于该微粒的叙述正确的是( )
表示,下列关于该微粒的叙述正确的是( )
A、所含质子数=A―n B、所含的中子数=A―Z
C、所含的电子数=Z+n D、质量数=Z+A
2.下列物品的用途与新型无机非金属材料无关的是( )
A.切割玻璃的刀 B.用于通讯的光缆
C.钟表的轴承 D.普通玻璃
3.水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是 ( )
A、市售的纯净水中矿物离子的含量相对较少
B、淡水的密度小于海水的密度
C、融化的雪水中矿物质含量比深井水中的少
D、0℃以上,温度越高,水的密度越小
4.检验CO2中含有SO2的试剂是( )
A、澄清的石灰水 B、NaOH溶液
C、品红溶液 D、湿润的蓝色石蕊试纸
5.下列各组物理量中,都不随取水量的变化而变化的是:( )
A、水的沸点;蒸发所需热量
B、水的密度;水中通入足量CO2后溶液的PH值
C、水的体积;电解水所消耗的电量
D、水的物质的量;水的摩尔质量
6.下列与晶体有关的叙述错误的是( )
A、熔点: NaCl > CsCl B、硬度: 晶体硅 < C(金刚石)
C、沸点:CF4 < CCl4 < CBr4 D、硬度:Al < Mg
7.在F、P、Si、Fe这四种元素中,每种元素都有某些方面区别于其它三种元素,若从中选出氟元素,选择的理由中正确的是( )
A、最高价氧化物对应的水化物酸性最强
B、单质与冷水反应最剧烈
C、单质固态时为分子晶体,熔沸点较低
D、在氧化物:OF6 、P2O5 、Fe2O3 中,OF6最稳定
8.下列离子反应方程式正确的是( )
A、用Zn和醋酸反应来制取H2 Zn + 2H+ = Zn2+ + H2↑
B、实验室制取NH3 NH4++OH- = NH4OH↑
C、尾气H2S用CuSO4溶液吸收 H2S + Cu2+= CuS↓+2H+
D、向漂白粉溶液中滴入少量的Na2SO3溶液 Ca2+ +SO32- = CaSO3↓
9.若将1molH2S氧化成为S,则消耗下列氧化剂的物质的量最少的是( )
A、KMnO4 (H+) B、Cl2 C、O2 D、SO2
10.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据,若该氧分子具有空间对称结构,你认为该氧分子是( )
A、氧元素的一种同位素 B、臭氧的同分异构体
C、一种新的氧化物 D、可能是非极性键构成的非极性分子
11.一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,用时将它们混合并用手搓揉就可致冷,且致冷效果能维持一段时间。以下关于其致冷原因的推猜测肯定错误的是( )
A、Na2SO4·10H2O脱水是吸热过程
B、较长时间致冷是由于Na2SO4·10H2O脱水是较慢的过程
C、铵盐在该条件下发生复分解反应是吸热反应
D、NH4NO3溶于水会吸收热量
12.酸根RO3―所含的电子数比硝酸根NO3―的电子数多10,则下列说话正确的是( )
A、R原子的电子层数比N的电子层数少1
B、RO3―中R的化合价与NO3―中N的化合价相等
C、RO3―和NO3―只能被还原,不能被氧化
D、R和N为同族元素
13.在氯化铁和氯化铝的混合溶液中,先加入过量的碘化钾溶液,再加入足量的硫化钠溶液,所得沉淀是( )
A、Al2S3和I2 B、Fe(OH)3和Al(OH)3
C、Fe2S3和I2 D、FeS、Al(OH)3和S
14.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的主要原因。假设某纳米颗粒的大小和结构恰好与氯化钠晶胞(最小结构单元)相同(如右图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
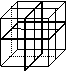 A、7:8 B、13:14 C、25:26 D、26:27
A、7:8 B、13:14 C、25:26 D、26:27
15.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
高三年级第四次月考化学试卷
答 案 卷
班级 姓名 学号 分数
一、 选择题(每小题只有一个正确答案,每小题3分,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第二卷(满分55分)
二、填空题(满分45分)
16.下图为一些常见仪器的部分结构:(7分)
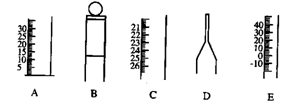 |
(1)请写出仪器名称:A B C D E
(2)检查B是否漏水的方法是
。
17.请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:(12分)
 |
(1)这些装置的连接顺序(按气体从左到右的方向)是:
![]()
![]()
![]()
![]()
![]()
![]()
![]() (填各接口的编号)
(填各接口的编号)
(2)实验时甲仪器的作用与原理是
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时I处滴入浓硫酸与II处加热催化剂的先后顺序是 。
(4)IV处观察到的现象是 。
(5)在I处用大火加热烧瓶时,SO2的转化率会 (填“增大”、“不变”或“减小” )
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为 。
18.(10分)A.一种无色气体X与红热的碳反应得到无色气体Y,Y与CuO反应又可得X,则X是 Y是 或X是 Y是
B.盐酸、硫酸和硝酸是三种重要的酸。
(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______
;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______
;
(3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______
;
(4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______
;
(5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______
;
(6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
19.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe2+。
(1)请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
(2)已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。
则总方程式为 。
20.(10分)根据下面物质间转换的框图,回答有关问题:
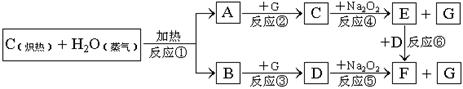
(1)由反应①产生的A、B混合物的工业名称是 。
(2)写出框图中D、E的电子式:D ;E
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是 _______L,同时反应中转移电子总数是 。(NA表示阿佛加德罗常数)
(4)请设计一个课堂小实验,证实反应⑤是放热反应。
(5)如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
三、计算题:(满分10分)
21.(4分)标况下由NO2、O2和NH3三种气体组成的混合气体11.2L,让其反复通过稀硝酸溶液,溶液质量增加14.2g,最后气体体积缩小到1.12L,该剩余气体遇空气不变色,求原混合气体的组成。
22.(6分)甲醇是一种重要的醇,它可以做内燃机的燃料和溶剂,也是一种重要的化工原料,同时它在废水处理中也有重要应用。
(1)在25℃时1g甲醇完全燃烧后恢复至原温度时可放出24.2kJ热量,则25℃时1mol甲醇完全燃烧生成100℃时CO2和水蒸气应放出 kJ热量。(保留整数)(有关热量公式Q=m·C·△t Q=m·J, 已知水的比热
C=4.18J·g-1·℃-1,水的液化热J=2253J·g-1 m:物质质量 △t:温度差 假设100℃时水完全汽化,并忽略CO2吸热)
(2)甲醇加入含氨的废水中,在一种微生物作用下发生反应:
2O2+NH3=NO3-+H++H2O, 6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,NH3→NO3-的转化率为95%,NO3-→N2的转化率为86%。若每天处理此种含NH3为34mg/L的废水500m3(密度1g/cm3)需要甲醇多少千克?(要求写出解题步骤,保留至小数点后一位)
部分参考答案
1B 2D 3D 4C 5B 6D 7B 8C 9A 10D 11C 12B 13D 14D 15B
16.(1)A量筒 B容量瓶 C滴定管 D胶头滴管 E温度计
(2)
19.(1)2NO2—2e-+2H2O=4H++2NO3—(2分) 2NO2+2e-+2H+=NO+H2O (2分)
(2)CH4+2O2+2OH—=CO32—+3H2O (2分)
21.(4分) NO24.48L、 O2 2.24L、NH34.48L
22.(6分)(1)682;
(2)解:由反应2O2+NH3=NO3-+H++H2O,
6NO3-+6H++5CH3OH→3N2↑+5CO2↑+13H2O
得关系式:6NH3—6NH3-—5CH3OH—3N2↑
![]()
![]() 根据关系式6NH3
5CH3OH
根据关系式6NH3
5CH3OH
6mol 5×32×10-3kg
1000mol×95%×86% m(CH3OH)
![]()
答:消耗甲醇21.8kg