高三年级8月月考试题化学
第I卷(50分)
一.单选题:(每小题2分)
1.“神舟”五号载人飞船成功升空和回收备受世界瞩目,其运载火箭“长征”二号F使用偏二甲肼(C2N2H8)和四氧化二氮作为推进剂,发生反应后生成N2、CO2和H2O。该反应配平后N2的化学计量数为
A.1 B.2 C.3 D.4
2.某无色透明的酸性溶液中能大量共存的一组离子是
A.NH4+ 、NO3-、Fe2+、Cl- B.Na+、HS-、K+、SO42-
C.MnO4-、K+、SO42-、Na+ D.Mg2+、Al3+、SO42-、NO3-
3.下列反应的离子方程式不正确的是:
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
C.碳酸钙中加入醋酸:CO32-+2CH3COOH=CO2↑+2CH3COO-+2H2O
D.硫氰化钾溶液加入三氯化铁溶液:Fe3++SCN-=[Fe(SCN)]2+
4.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A.跟水反应时,水作氧化剂 B.NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2生成 D.跟乙醇反应时,NaH被氧化
5.根据以下四个反应:
(1)H2S+I2=2H++2I-+S¯ (2)H2SO3+2H2S=3S¯+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
6.下列微粒①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-
既具有氧化性又具有还原性的是
A.①④⑤⑦ B.③⑥⑦⑧ C.④⑤⑥⑧ D.①②③⑥
7.下列各组在溶液中反应,不管反应物量是多少,都能用同一离子方程式表示的是
A.FeBr2与Cl2
B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
8.将3.20g Cu跟30.0mL 10.0mol·L-1的HNO3充分反应,还原产物有NO和NO2.若反应后溶液中有a mol H+离子,则此时溶液中含NO3-离子的物质的量为
A.(a+0.5)mol B.2 a mol C.0.1 a mol D.(a+0.1)mol
9.已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(l)+4H2O(液); ΔH=-2220KJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847KJ,则混合气体中氢气和丙烷的体积比为
A. 1:3 B.1:4 C. 3:1 D.1:1
10.用15mL2mol· L-1的H2SO4溶液与15mL3 mol· L-1的Na2CO3溶液反应来制取二氧化碳,欲制得最多的二氧化碳,则下列叙述正确的是
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把Na2CO3溶液滴加到H2SO4溶液中
D.把H2SO4溶液滴加到Na2CO3溶液中
二.单选题:(每小题3分)
11.下列各组溶液,不用其它试剂就可以将它们区别开的是
A.盐酸、氢氧化钾、硫酸钾、碳酸钾 B.硝酸钠、盐酸、氯化铵、氢氧化钾
C.氯化钡、氯化钙、硫酸钠、硝酸钾 D.氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
12.在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑中,5mol水能还原的BrF3的物质的量为:
A.1mol B.4/3mol C.2mol D.3mol
13.在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下
2ICl+2Zn=ZnCl2+Znl2 ICl+H2O=HCl+HIO
下列关于ICl性质的叙述正确的是
A.ZnCl2是氧化产物,又是还原产物 B.ZnI2是氧化产物,又是还原产物
C.ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂
D.ICl跟H2O的反应,是自身氧化还原反应
14.Na3N是离子化合物,它和水作用可产生NH3,下列说法正确的是
A.Na+和N3-的电子层结构都与氖原子相同 B.Na+的半径大于N3-的半径
C.Na3N与盐酸反应只能生成一种盐 D.Na3N和水反应时,Na3N是还原剂
15.将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液. 然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为
A.0.92g B.0.69g .C.0.64g D.0.23g
16.某种干燥粉末混合物可能由Na2O、Na2CO3、、Na2O2、NaCl、NaHCO3中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是
A.一定含有![]() B.一定含有
B.一定含有![]() 和NaCl
和NaCl
C.不含有![]() D.不含有
D.不含有![]()
17.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC-COOH
A.全部 B.仅(4)(5) C.仅(1)(2)(3) D.除(5)以外
18.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C 和O2
19.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有
A.NaNO2 NO H2O B.NaNO3 NaOH O2 H2O
C.NaNO3 H2O
D.NaNO3
HNO3
O2 H2O
20.将23克金属钠放入足量mg水中,再将24克金属镁放入足量m克稀盐酸中。反应后所得溶液的质量分别为![]() 克和
克和![]() 克。那么,
克。那么,![]() 和
和![]() 两数值的关系应是
两数值的关系应是
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
将选择题的答案填入下表
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第II卷(50分)
三、按要求完成下列各题(共27分)
21.写出下列离子方程式:(6分)
(1)氢氧化钠溶液中加入少量的Ca(HCO3)2溶液
(2)将过量的二氧化碳气体通入到偏铝酸钠溶液中
(3)将少量的明矾溶液滴加到氢氧化钾溶液中
22.(6分).某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是_____________;
(2)如果该反应方程式中I2和KIO3的系数都是5,则KMnO4的系数是____,完成方程式并标出电子的转移方向和数目
KMnO4+ KI+ H2SO4 →
23(9)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO2-、SO32-、SO42-。现取该溶液进行有关实验,实验结果如下所示:
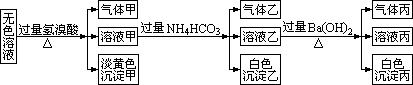
(1)沉淀甲是______,生成沉淀甲的离子方程式为_____________________。
(2)沉淀乙是______,由溶液甲生成沉淀乙的离子方程式为_____________。
(3)沉淀丙是______,用化学实验来确定其成分,其方法是____________。
(4)气体甲的成分有哪几种可能?答:____________________________________。
(5)综合上述信息,可以肯定存在的离子 __________________________________。
24.(6分)把温度为13℃,浓度为1.0 mol·L-1的盐酸和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3·H2O | 13 | 19.3 | △H2 |
(1)试计算上述两组实验测出的中和热:△H1=___________;△H2=___________。
(2)实验中碱液过量的目的是___________________________________________。
(3)两组实验结果差异的原因是__________________________________________。
四、实验题 (本题16分)
25.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2=2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
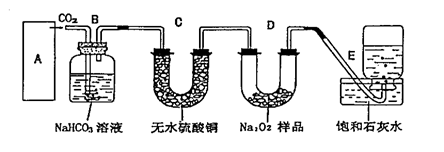
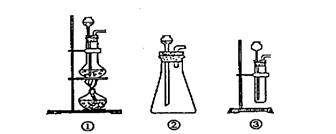 |
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)当D中的1.95克过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大或小),相差约 毫升(取整数值,所用数据均在标准状况下测定),这是由于
。
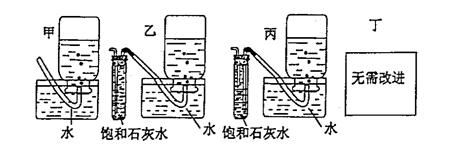 |
(5)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要改为下列四项中的哪一项: 。(用甲、乙、丙、丁回答)
四、计算题(共7分)
26.将50mL由pH=1的硫酸和盐酸组成的混合溶液与50mL Ba(OH)2 溶液混合,充分反应后过滤,得0.466g 沉淀,溶液(100mL)中OH-离子浓度为0.1 mol·L-1。求:
(1)原混合液中SO42-、Cl-的物质的量。
(2)Ba(OH)2溶液的物质的量浓度。
答案
21.略
22.略
23.(1)S;2S2-+SO32-+6H+=3S↓+3H2O
(2)Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)BaCO3,可能有BaSO4;在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外,还有BaSO4,若全部溶解,则仅有BaCO3
(4)①CO2;②H2S;③SO2;④CO2、H2S;⑤CO2、SO2
(5)S2-、SO32-、AlO2-
24.(1)根据给出的酸和碱的物质的量,酸为0.050mol,碱为0.055mol,碱是过量的,应以酸计算,算出生成0.050mol水放出的热量,进而算出生成1mol水放出的热量,即可得出两组实验测出的中和热数值。
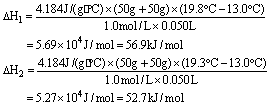
(2)碱液过量是为了提高实验准确度,因NaOH溶液易吸收CO2,而使NaOH浓度下降,NH3·H2O易挥发也使NH3·H2O浓度下降。
(3)NaOH是强碱,在水溶液中完全电解,跟HCl中和时放热较多,NH3·H2O是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少。
25.(1)②;白色固体变蓝色;带有余烬;复燃。
(2)未反应的二氧化碳与石灰水反应所致。
(3)由于生成氧气的量减少,E中可能会因二氧化碳与石灰水反应而倒吸。
(4)小;30;Na2O2可能含有其它杂质;D装置可能有氧气未被排出。。。。
(5)不安全,不合理;乙。
26.(1)由SO42-+Ba2+=BaSO4↓知原溶液中SO42-的物质的量为:
![]()
原溶液中H+的物质的量n(H+)=0.050L×0.1mol/L=0.005mol
原溶液中Cl-的物质的量为
n(Cl-)=n(H+)-2n(SO42-)=0.005mol-0.002mol×2=0.001mol.
(2)Ba(OH)2的物质的量为
![]()
Ba(OH)2溶液的物质的量浓度为
![]()