高三化学强化训练(二)
第Ⅰ卷(共72分)
相对原子质量:C—12;N—14;Mg-24;S—32;K—39;Fe—56;I—127;Cl—35.5
一、 选择题(本题共30分,每小题3分,只有一个正确选项。)
1.VCD光盘上的光记录材料有很多种,他们都可以在激光照射下发生化学或物理性能的改变从而记录储存信号。碲的化合物是常用的VCD光记录材料中的一种,对碲元素及其化合物的下列认识,不正确的是
A.Te元素位于元素周期表中的第四周期第ⅥA族
B.Cl2通入H2Te溶液中不发生反应
C.碲化氢的化学式是H2Te
D.单质碲在常温下是固体
2.某雨水样品刚采集时测得pH值为4.82,放在烧坏中经2小时后,再次测得pH值为4.68。以下叙述正确的是
A.雨水样品酸度逐渐减小 B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
3.下列各组物理量中,都不随取水量的变化而变化的是
A.水的沸点;蒸发水所需热量 B.水的密度;水中通人足量CO2后溶液的pH
C.水的体积;电解水所消耗的电量 D.水的物质的量;水的摩尔质量
4.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(气)+B(气)=2C(气);若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B. ①④ C. ②③ D. ③④相对原子质量:
5.下列物质不属于“城市空气质量日报”报道的是
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
6.下列分子的电子式书写正确的是
A.氨 ![]() B.四氯化碳
B.四氯化碳 ![]()
C.氮 ![]() D.二氧化碳
D.二氧化碳 ![]()
7.下列物质属于分子晶体的化合物是
A.石英 B、硫磺 C、干冰 D、食盐
8.铜片和锌片用导线连接后插入稀硫酸中,锌片是
A、阴极 B、正极 C、阳极 D、负极
9.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是
A、H2S、SO2 B、O2 C、H2S D、SO3
10.碱金属与卤素所形成的化合物大都具有的性质是
① 高沸点 ② 能溶于水 ② 水溶液能导电 ④ 低熔点 ⑤ 熔融状态不导电
A、①②③ B、③④⑤ C、①④⑤ D、②③⑤
二、选择题(本题共32分,每小题4分,有1~2个正确选项)
11.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A、H3O+、NO3-、Fe2+、Na+ B、Fe3+、K+、Cl-、I—
C、K+、Ba2+、OH-、SO42- D、Cu2+、NH4+、Br-、OH-
12.下列反应的离子方程式错误的是
A.向碳酸氢钙溶液中加人过量氢氧化钠
Ca2++2HCO3-+2OH-== CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH++HCO3-== BaCO3↓+NH3·H2O+H2O
C.过量偏铝酸钠溶液与盐酸反应:AlO2—+4H+== Al3++2H2O
D.过量CO2通入氢氧化钠溶液中:CO2+2OH-== CO32-+H2O
13.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A、分散质颗粒直径都在l~100nm之间 B、能透过半透膜
C、加热蒸干、灼烧后都有氧化铁生成 D、呈红褐色
14.下列实验中用错试剂的是
A、用稀盐酸清洗做焰色反应的镍铬丝 B、用酒精萃取碘水中的碘
C、用稀硝酸洗去残留在试管壁上的铜 D、用碱石灰吸收氨气中的水蒸气
15.设NA为阿佛加德罗常数,下列说法不正确的是
A、标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B、18g水中含有的电子数为10NA
C、46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
D、在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
16.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A、NaHSO4和Ba(OH)2 B、AlCl3和NaOH
C、NaAlO2和H2SO4 D、Ba(HCO3)2和Ba(OH)2
17.将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A、C (Ac-)>C (Cl-)>C (H+)>C (HAc)
B、C (Ac-)>C (Cl-)>C (HAc)>C(H+)
C、C (Ac-)=C (Cl+)>C (H+)>C (HAc)
D、C (Na+)+C (H+) = C (Ac-)+C (Cl-)+C (OH-)
18.某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
A、NaOH溶液的体积大于氨水 B、NaOH溶液的体积等于氨水
C、NaOH溶液的体积小于氨水 D、无法判断
第Ⅱ卷(共84分)
19.加碘食盐中的碘以KIO3的形式存在。如果要检验所购买的食盐中是否含碘,可以取少量溶入用稀硫酸酸化的水中,再滴入碘化钾淀粉溶液(或用碘化钾淀粉试纸)。请回答下列问题:
⑴此反应化学方程式如下,请将方程式配平(系数填入方框内):
KIO3 + KI + H2SO4 = K2SO4 + I2 + H2O;
⑵实验中,若出现 现象,就说明是加碘盐;
⑶该实验氧化剂是 (填化学式)。
19. (4分) KIO3 + 5 KI +3 H2SO4 = 3K2SO4 + 3 I2 + 3 H2O;⑵变蓝色;
⑶KIO3。20. (5分) 请回答下列有关实验基本操作的问题:
⑴现有几种试纸:石蕊试纸、pH试纸、淀粉碘化钾试纸, 使用时绝对不能用蒸馏水润湿、只能用玻棒将待测液粘在试纸上测定才准确的是 。
⑵托盘天平称量只能精确到 g;称量时左盘放 ,右盘放 。
⑶用某浓盐酸配制250mL的0.10 mol·L-1 稀盐酸时,需要用到下列仪器中的玻璃仪器是(填编号): 。
① 托盘天平、②量筒、③玻棒、④烧杯、⑤250mL容量瓶、⑥胶头滴管、⑦锥形瓶。
20. (5分)⑴pH试纸。⑵0.1;药品,砝码。⑶②③④⑤⑥。(每空1分)21.1999年诺贝尔化学奖授予具有埃及和美国双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时原子的运动成为可能”。
1.泽维尔用飞秒(时间单位:1飞秒=10-15秒)激光技术研究了氰化碘(ICN)的分解反应 ICN→I+CN,发现该变化可在200飞秒内完成。已知(CN)2和卤素的性质相似。以下有关ICN的叙述中正确的是
A ICN不能和NaOH溶液反应
B ICN是一种共价化合物
C 将ICN加入到AgNO3溶液中可生成黑色沉淀
D ICN的晶体是分子晶体
2.泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距1~1.5nm,呈离子键;当两核靠近约距0.28nm,呈共价健。以下叙述中正确的是
A 共价键和离子键之间没有明显的界限
B NaI晶体中既有离子键,又有共价键
C 离子晶体中可能含共价键
D NaI晶体是离子晶体和分子晶体的混合物
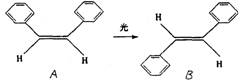
3.泽维尔用四氟二碘化碳做了下面的实验:
![]()
(“…”表示伸向纸内,“![]() ”表示伸向纸外)
”表示伸向纸外)
发现两个完全符同的C-I键是一先一后断裂的。以下有关上述反应类型的判断中正确的是
A 取代反应 B 加成反应 C 消去反应 D 加聚反应
4.泽维尔证实了光可诱发下列过程:
这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率。以下叙述中正确的是
A 上述变化是化学变化
B A、B是同一种物质
C A、B的分子式是C14H14
D A、B都能发生加聚反应
【参考答案】
1. B、D
2. A、C
3. C
A、D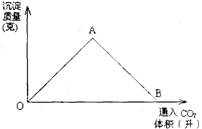 22.图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试回答:
22.图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试回答:
OA段曲线和AB段曲线所表示的反应方程式是
OA:
AB:
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为1比 。
B处溶液中存在的浓度较大的两种离子是 和 。(填离于符号)
将B处生成的溶液煮沸,可见到的现象是
23.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。