高三化学上期练习01
可能用到的相对原子质量:K 39 Cl 35.5 Ag 108 N 14 O 16 Br 80 Cu 64
第 Ⅰ 卷 (选择题 共72分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.海湾战争中,科威特大批油井着火,在灭火工作中,下列措施不能考虑用于灭火的是
( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法降低石油着火点 D.设法使火焰隔绝空气
2.下列各组微粒,氧化性由强到弱顺序排列的是 ( )
A.F2、C12、Br2、I2 B.Cu、Fe、Al、Mg
C.Cu2+、H+、Zn2+、Fe2+ D.F-、C1-、Br-、I-
3.充分燃烧一定量的丁烷(C4H10)放出热量为Q,经测定完全吸收它生成的CO2需消耗
5mol/LKOH溶液100mL,恰好生成正盐。则燃烧1mol丁烷放出的热量为 ( )
A.4Q B.5Q C.8Q D.16Q
4.强电解质溶液的导电能力和弱电解质溶液的导电能力 ( )
A. 大于 B. 小于 C. 等于 D. 不能肯定
5.已知C(石墨)→C(金刚石),ΔH=+119KJ/mol,则可判断 ( )
A. 金刚石比石墨稳定 B. 一样稳定
C.石墨比金刚石稳定 D. 无法判断
6.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵(NH4Ac)溶液形成无色溶液,其化学方程式是PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4,当在醋酸铅(Pb(Ac)2)溶液中通入弱电解质H2S时,有黑色沉淀PbS生成.表示这个反应的有关离子方程式正确的是 ( )
A.Pb(Ac)2+H2S=PbS↓+2HAc B.Pb2++H2S=PbS↓+2H+
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
7.含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46KJ的热量,该反应的热化学方程式正确的是 ( )
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH= -11.46 KJ/mo1
K2SO4(aq)+H2O(l) ΔH= -11.46 KJ/mo1
B. 2KOH(aq) +H2SO4(aq)= K2SO4(aq)+2H2O(aq) ΔH= -114.6 KJ/mo1
C.2KOH(aq)+ H2SO4(aq)= K2SO4(aq)+2H2Ol ΔH=-114.6 KJ/mo1
D.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+ H2O(1) ΔH=-57.3 KJ/mo1
K2SO4(aq)+ H2O(1) ΔH=-57.3 KJ/mo1
8.已知下列热化学方程式:
C(s)+O2(g)=CO2(g) ΔH= -393.5 KJ/mo1
2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 KJ/mo1
现有0.2mol的炭粉和氢气组成的悬浊气、固混合物在氧气中完全燃烧,共放出63.53 KJ
热量,则炭粉与氢气的物质的量之比为 ( )
A.1∶1 B.1∶2 C.2∶3 D.3∶2
二、选择题(本题包括16小题,每小题3分,共48分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.下列反应是吸热反应的是 ( )
A.灼热的炭与二氧化碳反应
B.铁和稀硫酸的反应
C.氢氧化钡晶体的粉末和氯化铵晶体混合
D.木炭在氧气中燃烧
10.某无色透明溶液中,由水电离出来的c(H+)=1×10-3mol/L,在该溶液中一定能够大量共存的离子组是 ( )
A.K+、Na+、MnO4-、NO3- B.Fe3+、A13+、Cl-、HS-
C:NH4+、A1O2-、Na+、CH3COO- D.K+、Na+、SO42-、NO3-
11翰林汇. 区别电解质强弱的合理依据是 ( )
A. 溶液的导电能力 B. 一定浓度时的电离程度
C. 水溶性大小 D. 与酸或碱反应时消耗酸或碱的量翰林汇
12. 下列离子方程式正确的是 ( )
A.FeS和稀硝酸反应
FeS+2H+=Fe2++H2S↑
B. 溴化亚铁溶液中通入过量氯气
2Fe2++4Br-+3C12=2Fe3++6Cl-+2Br2
C.钠与水反应
Na+2H2O=Na++2OH-+H2↑
D.碳酸氢钙溶液与过量氢氧化钠溶液反应
Ca2++HCO3-+OH-=CaCO3↓+H2O
13. 同浓度,同体积的下列物质后者滴入前者的过程中,溶液的导电性变化不大 ( )
A.氨水,盐酸 B.硫酸镁,氢氧化钠
C.氢氧化钡,盐酸 D.氢氧化钡,硫酸铜
14.下列盐溶液中加入氯化钡溶液生成白色沉淀,再加入足量稀硝酸振荡后,白色沉淀完全消失的是 ( )
A.Na2SO3 B.AgNO3
C.Na3PO4 D.Na2SiO3
15.现有一反应方程式:
a FeCl2+b KNO3+c HCl![]() d FeCl3+e KCl+f X+g H2O,若b=1,d=3,则x的化学式
d FeCl3+e KCl+f X+g H2O,若b=1,d=3,则x的化学式
( )
A.N2 B.NO C. NO2 D.NH4Cl
16. 下列说法中正确的是 ( )
A.如果某一反应的反应物能量总和高于生成物能量总和,则该反应是吸热反应
B.我国目前使用最多的燃料是酒精
C.煤炭直接燃烧不仅产生大量烟尘,而且生成SO2,导致酸雨的形成
D.煤经过处理后制得水煤气、干馏煤气等,可提高燃烧效率和减少环境污染
17. 含有KAl(SO4)2和A1C13的混合溶液中滴入Ba(OH)2溶液,若能得到沉淀最多时,则KAl(SO4)2和A1C13的物质的量之比为 ( )
A.1∶1 B.2∶1 C.3∶1 D.3∶2
18. 下列说法正确的是 ( )
A. 需要加热才能发生的反应一定是吸热反应
B. 任何放热反应在常温条件下一定能发生反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 吸热反应在一定条件下(如常温、加热等)也能发生反应
19. 下列叙述中,正确的是 ( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素的化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
20. 为实现中国2000年消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)形式存在。已知在溶液中IO3—可和I—发生反应:IO3—+ I—==3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3—。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是 ( )
A. ①③ B. ③⑥ C. ②④⑥ D. ①②④⑤⑦
21. 在反应X+2Y==R+2M中,已知R、M的相对分子质量之比为22:9。当1.6gX与Y完全反应后,生成4.4gR,则在此反应中Y、M的质量之比为 ( )
A.16:9 B. 23:9 C. 32:9 D. 46:9
22.把少量氢氧化钠固体分别加入到100mL的下列溶液中,溶液的导电能力变化最小的是
( )
A. 自来水 B. 盐酸溶液 C. 醋酸溶液 D. 氯化钾溶液
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源;需要依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:水吸收能量分解为H2和O2。根据以上叙述回答下面二题:
23. 下列叙述正确的是 ( )
A. 电能是二级能源 B. 水力是二级能源
C. 天然气是一级能源 D. 水煤气是一级能源
24. 关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A. 设法将太阳光聚集,产生高温,使水分解产生氢气
B. 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
C. 寻找特殊化学物质,用于开发廉价能源以分解水制取氢气
D. 寻找高效催化剂,使水分解产生氢气,同时释放能量
第 Ⅱ 卷 (非选择题 共78分)
三、(本题包括2小题,共19分)
25. (9分)在燃烧正旺的煤炉上添加新煤时,发现炉温下降,同时在新煤上方,有蓝色火焰出现。写出该过程中发生反应的化学方程式,并说明是吸热反应,还是放热反应。
⑴燃烧正旺的反应___________________________,___热反应;
⑵炉温下降的反应___________________________,___热反应;
⑶蓝色火焰的反应_____________________________,___热反应。
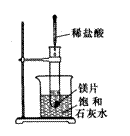 26. (10分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,
26. (10分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,
试管中开始放入几小块镁片,再用滴管滴人5mL盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是________________
______________________________________________________。
(2)产生上述现象的原因是_______________________________
__________________________________________________________
________________________________________________________________________。
(3)写出有关反应的离子方程式___________________________。
(4)由实验推知,MgCl2溶液和H2的总能量___________(填“大于”、“小于”、“等于”)镁片和盐酸的总能量。
四、(本题包括2小题,共20分)
27.(8分)在铁、铜的混合物中,加入一定量的稀NHO3,充分反应后,剩余金属m,试回答:
①若剩余金属中含有铁,则反应的化学方程式为________________
______________________________________________。
②若剩余金属只有铜,再向溶液中加入足量稀硫酸,此时剩余金属减少,则反应的离子方程式为_________________________________。
28.(12分)某溶液中可能会有C1-、Br-、CO32-、PO43-、SO42-等阴离子;
(1)向原溶液中滴入盐酸至过量,则溶液中离子________转化为气体而被除去。
(2)向原溶液中通入足量氯气后,溶液中离子________因被氧化而不再存在。
(3)当原溶液中同时存在较多____和_____两种离子时,上述所有离子都不存在于溶液中。
五、(本题包括2小题,共20分)
29.(12分)在一定条件下,单质A和B反应,生成化合物C,C与水反应生成气体D和白色沉淀E(如下框图所示):
|
![]()
|
|
|
|
(1)若E只溶于强酸,则C为______,C与H2O反应的化学方程式为________________;
(2)若E既溶于强碱,又溶于强酸,则C为______,C与H2O反应的方程式为 _____________________;
(3)当生成相同物质的量的气体D时,生成沉淀E的物质的量之比为_____________。
30.(8分)将Zn、Cu混合粉末投入含有FeCl3、FeCl2、CuCl2的混合溶液中,充分反应后,据此回答下列问题(填金属和金属阳离子):
⑴若容器内有Zn剩余,则剩余固体中还有_________;溶液中的金属离子为__________。
(2)若溶液中含有Fe3+,溶液中的金属阳离子为________;
(3)若溶液中含有Cu2+,剩余固体中含有铜,则溶液中还存在的金属阳离子有_________。
六、(本题包括2小题,共19分)
31. (9分)KBr和KCl的混合物3.87g,溶于水并加入过量AgNO3溶液后,产生6.63gAgBr与AgCl沉淀混合物,试计算原混合物中含K+的质量分数。
32. (10分)在某100ml混合液中,HN03和H2S04的物质的量浓度分别是:0.4mol/L、
0.1mol/L。向该混合液中加入1.92克铜粉,加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是多少?
参考答案
1.C 2.A 3.D 4. D 5.C 6.A [解题思路]复分解反应完成的条件是:有沉淀产生或有气体产生或有弱电解质产生。根据题意,可以判断出Pb(Ac)2是弱电解质,所以在离子方程式中Pb(Ac)2不能写成离子形式。 7.D 8.A 9.AC 10.D 11. B 12.B 13.BC 14.C 15.B 16 .CD 17.C 18. CD[解题思路]A. 需要加热才能发生的反应不一定是吸热反应,如煤的燃烧,一开始需要加热,但该反应是放热反应。B. 放热反应也需要在一定条件下才能发生反应。如可燃物的燃烧必须达到一定的着火点。C.反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。D.放热反应和吸热反应在一定的条件下都能发生。反应开始时需加热的反应可能是吸热反应,也可能是放热反应。19.AD 20.B 21.A 22.B 23. AC 24.BD [解题思路] 第一问直接根据题目的提示得出A和C是正确的,而水力是一级能源,水煤气通过炽热的炭和水蒸气反应制得,故是二级能源。第二问中B和D本身说法就不对,氧气只能助燃而不能燃烧;水分解产生H2和O2的过程要吸收热(题目提示)。
25. (9分) ⑴C+O2![]() CO2,(2分) 放(1分); ⑵CO2+C
CO2,(2分) 放(1分); ⑵CO2+C![]() 2C0(2分) 吸(1分);
2C0(2分) 吸(1分);
⑶2C0+O2![]() 2C02(2分) 放(1分)。
2C02(2分) 放(1分)。
[解题思路] 燃烧正旺的煤炉进行的反应是碳燃烧生成二氧化碳,这是放热反应;添加新煤时炉温下降,主要是因为进行的反应是吸热反应,这是碳与二氧化碳化合生成一氧化碳的反应;产生的一氧化碳是可燃性气体,燃烧时产生蓝色火焰,也是放热反应。
26.(10分) (1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体。(3分)
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体。 (3分) (3)Mg+2H+=Mg2++H2↑。(2分) (4)小于(2分)。
[解题思路]镁是比较活泼的金属,能与盐酸反应生成H2,所以会看到现象①和②,同时由教材中铝与盐酸反应是放热反应,类推出镁与盐取反应为放热反应。而Ca(OH)2在水中的溶解度随温度升高而减小,因而还可看到现象③。因该反应是一个放热反应,所以生成物的总能量小于反应物的总能量。
27. (8分)①Fe+4HNO3===Fe(NO3)3+ NO↑+H2O (3分)
Fe+2Fe(NO3)3===3Fe(NO3)2 (2分)
②3Cu+8H++2NO3-===3Cu 2++2 NO↑+4H2O (3分)
28. (12分) ⑴CO32- ⑵Br- ⑶Ag+;Ba2+(每线3分)
29. (12分) ⑴Mg3N2(2分);Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑(2分)
⑵Al2S3(2分);Al2S3+6H2O===3Al(OH)3↓+3H2S↑(2分)
⑶9∶4(4分)
30. (8分) ⑴Fe、Cu(2分);Zn2+(1分);⑵Zn2+、Fe2+、Cu2+(3分);⑶Zn2+、Fe2+(2分)
31.(9分) 设含K质量为x (1分)
K——KBr、KCl——AgBr、AgCl——Ag △W
39 108 108-39=69 (2分)
x 3.87g 6.63g 6.63g-3.87g=2.76g (2分)
因为Br、Cl的质量不变,所以质量差为Ag的质量减去K的质量
39:69=x:2.67g (1分)
x=1.56g (1分)
K%=![]() ×100%=40.3%
(1分)
×100%=40.3%
(1分)
答:原混合物中含K+的质量分数为40.3% (1分)
32. (10分)[解题思路] 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O (1分)
根据题意:
n(H+)=(0.4mol/L+0.1×2 mol/L )× 0.1L=0.6 mol (1分)
n(Cu)=![]() =0.03mol
(1分)
=0.03mol
(1分)
n(NO3-)=0.4 mol/L×0.1 L=0.04 mol (1分)
n(H+):n(N03-)=0.06 mol:0.04 mol =3:2<8:2 (1分)
n(Cu):n(N03-)=0.03 mol:0.04 mol =3:4>3:2说明NO3-过量 (1分)
n(H+):n(Cu)=0.06 mol:0.03 mol=2:1>8:3说明Cu过量 (1分)
故用H+做计算,可得:
参加反应n (Cu)= n (Cu2+)=0.06 mol ×![]() =0.0225mol/L
(2分)
=0.0225mol/L
(2分)
c(Cu2)=![]() =0.225mol/L
(1分)
=0.225mol/L
(1分)
[易错点]该题很容易让同学产生误解,认为Cu跟稀H2S04不起反应,只和稀HNO3起反应,生成Cu(NO3)2、NO、H20,实际上反应生成的Cu(NO3)2中的N03-可跟稀H2S04中的H+形成HNO3,继续跟Cu起反应,故该计算只能利用离子方程式计算。