高三化学上期练习02
可能用到的相对原子质量:Na 23 Al 27 H 1 O 16 C 12 Fe 56 Hg 200.6 Cu 64
第 Ⅰ 卷 (选择题 共72分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是 ( )
A. K B. Ca C. Na D. Fe
翰林汇2.将少量金属钠长时间放置在空气中,最终的产物是
A. NaOH B. Na2CO3 C. Na2O D. Na2O2
3.铁的冶炼在我国具有悠久的历史,最早约在 ( )
A. 夏朝 B. 商代 C. 春秋战国 D. 西汉
4.我国是世界上研究超导技术比较先进的国家,在高温超导材料中,铊(Ti)是重要成分之一,已知铊与铝是同主族元素,关于铊的性质推断可能错误的是 ( )
A. 铊是银白色、质软的金属 B. 铊不能形成气态氢化物
C. 铊与稀硝酸反应生成Ti(NO3)3 D. Ti(OH)3是两性氢氧化物
5. 下列对过氧化钠的叙述中,正确的是 ( )
A.在反应中只能做氧化剂
B.它与活性炭一样均具有漂白性,且漂白原理相同
C. 用于防毒面具上
D.CO2与Na2O2反应,CO2为氧化剂,Na2O2为还原剂
6.下列关于NaHC03的叙述中,不正确的是 ( )
A.不能与KOH反应
B.治疗胃酸过多的一种药剂
C.在其水溶液中加入石灰水有白色沉淀产生
D.能和稀硫酸反应放出无色无刺激性气味的气体
7.镁粉在焰火、闪光粉、鞭炮中是不可少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是
( )
A. ①和② B. ②和③ C. ③和④ D. ④和⑤
8翰林汇. 下列灭火剂能用于扑灭金属钠着火的是 ( )
A. 干冰灭火剂 B. 黄砂
C. 泡沫灭火剂 D. 干粉(含NaHCO3)灭火剂
二、选择题(本题包括16小题,每小题3分,共48分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.钠的下列用途与钠的化学性质无关的是 ( )
A. 制取过氧化钠 B. 作原子反应堆导热剂
C. 冶炼金属钛 D. 广泛应用在电光源上
10.Li不可能具有的性质是 ( )
A.Li在空气中燃烧可生成Li2O2 B.Li很软,用小刀可以切割
C.Li比金属铯的熔点高 D.金属Li可以保存在煤油或液体石蜡中
翰林汇11. 在20oC时,100g水溶解mgNa2CO3达到饱和状态;同时在100g水中溶解ng Na2CO3· 10H2O
也达到饱和状态,则m与n的关系是 ( )
A. m=n B. m>n C. m<n D. 无法判断
12.将一块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象是
( )
A. 钠浮在试管中的液面上 B. 钠沉人试管中溶液的底部
C. 钠在煤油里燃烧起来 D. 钠处于水和煤油的交界处
13.将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是
( )
A. Na2CO3 B. Na2O和Na2O2
C. Na2O2 D. Na2O2和Na2CO3
14.下列离子方程式中, 正确的是 ( )
A.在氯化铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓
B.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓
C.在澄清石灰水中通入过量二氧化碳 OH-+CO2=HCO3-
D.在碳酸氢钙溶液中加入过量氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O
15.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)︰c(Fe2+)=2︰3,则Cu2+与Fe3+的物质的量之比为 ( )
A.3︰2 B.3︰5 C.4︰3 D.3︰4
16.下列有关热分解冶炼金属的说法中不正确的是 ( )
A.Ag2O受热就能分解,Ag用热分解法制得
B.Ag2O受热分解的反应中,Ag2O既是氧化剂,又是还原剂
C.WO3受热分解,W可用热分解法制得
D.工业上制汞既可用热分解法,也可用热还原法
17.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是 ( )
A. 22.2% B. 30% C. 75.5% D. 80.6%
18.金属K与Na金属性相近,用K与Na盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点℃ 63.65 97.8 770 801
沸点℃ 774 882 1500(升华) 1431
根据平衡移动原理,可推知,用Na与KCl反应制K的适宜温度是 ( )
A. 97.8℃~770℃ B. 770℃~774℃
C. 774℃~882.9℃ D. 1413℃~1500℃
19.NaOH和NaHCO3固体混合物在密闭容器中加热,充分反应后,排除气体,冷却后残留物可能是 ( )
⑴NaOH ⑵Na2CO3 ⑶NaHCO3 ⑷NaOH和Na2CO3 ⑸Na2CO3和NaHCO3
A. ⑴ B. ⑵和⑷ C. ⑷和⑸ D. ⑶
20.欲除去小苏打溶液中少量的苏打杂质,最宜选用加入的物质是 ( )
A. 干冰 B. 盐酸 C. 碳酸氢钙 D. 氢氧化钙
21.能用来分离Fe3+和Al3+的试剂是 ( )
A. 氨水 B. NaOH溶液和盐酸
C. 氨水和盐酸 D. NaOH溶液
22.按下列过程,最终能够实现的是 ( )
|
|
|
![]()
![]()
![]() A.Fe
FeCl2溶液
FeCl3溶液
FeCl3晶体
A.Fe
FeCl2溶液
FeCl3溶液
FeCl3晶体
|
|
|
![]()
![]()
![]() B.FeSO4溶液
Fe(OH)2 Fe(OH)3
Fe2(SO4)3溶液
B.FeSO4溶液
Fe(OH)2 Fe(OH)3
Fe2(SO4)3溶液
|
![]()
|
|
|
|
|
|
|
23.由铁、锌、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是 ( )
A. 锌 B. 铁 C. 铝 D. 镁
24.相同质量的Na、Mg、Al与过量稀硫酸反应,在相同状况下产生H2的质量比为 ( )
A. 36:69:92 B. 92:69:36 C. 1:1:1 D. 3:2:1
第 Ⅱ 卷 (非选择题 共78分)
三、(本题包括2小题,共19分)
翰林汇翰林汇25. (11分)已知某白色粉末不是硝酸盐,为鉴定此物质,先将它溶于水制成无色溶液A,再对
A做下列实验,根据现象写出各步推断和最后结论:
| 实 验 步 骤 | 实 验 现 象 | 推 断 |
| ①取少量A,加入BaCl2溶液 | 无现象,得混合溶液B | |
| ②向B中加入少量NaOH溶液 | 生成白色沉淀C | |
| ③滤出C,加盐酸 | 放出无色、无嗅气体D | |
| ④D通入澄清石灰水 | 产生白色沉淀 | |
| ⑤用A做焰色反应 | 焰色为黄色 |
结论:此物质为____________。
|
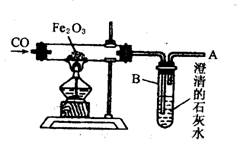
(1)判断硬质玻璃管中已开始发生反应的方法是_________________________________。
(2)反应过程中发生的现象是_________________________________________________。
(3)在A处点燃可见浅蓝色火焰的原因是_______________________________________。
(4)实验结束时应注意的操作是_______________________________________________。
①先停止通入CO2;②先熄灭酒精灯,并继续通入CO;③熄灭酒精灯,同时停止通入CO;④先熄灭酒精灯,继续通入CO,并点燃排出的CO气体。
四、(本题包括2小题,共20分)
27.(10分)有A、B、C、D、E、F 6种化合物,其中A、B、C、D是铝元素的化合物,F是一种气体,在标准状况下,F的密度是空气密度的1.103倍。化合物间发生如下反应:
![]() ①A+NaOH
D+H2O
②B
①A+NaOH
D+H2O
②B![]() A+H2O
A+H2O
![]()
![]() ③C+NaOH(适量)
B+NaCl ④E+H2O
NaOH+F
③C+NaOH(适量)
B+NaCl ④E+H2O
NaOH+F
(1)确定物质A、B、C、D的化学式:A_______,B________,C________,D________。
(2)1 mol和2 mol E在水溶液中发生反应的化学方程式为__________________________。
28.(10分)A、B、C、D四种化合物其焰色反应均为紫色,A、B、C和盐酸反应均得到D,将固体C加热可制得A,若在A的溶液中通入一种无色无味气体,又可制得C,若B与C的溶液混合可制得A,试推断
(1)A是________,B是_________,C是_________,D是__________。
(2)完成有关方程式:
C![]() A
________________________;A—→C __________________________;
A
________________________;A—→C __________________________;
B+C—→A _______________________________________________。
五、(本题包括2小题,共20分)
29.(8分)在长期载人太空飞行的航行器中,每个宇航员平均每天需消耗0.9kg氧气,呼出1.0kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。有的科学家得出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是:
①__________________________________;②_______________________________ 。将处理后的气体充入座舱时,应注意采取的一项措施是_____________________________。
有人提出用超氧化钾(K02)代替过氧化钠供氧,预计其优点是_______________________。
30.(12分)⑴铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染源”之一而加以控制。铝在下列使用场合须加以控制的是:①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用AlOH)3制成药片治胃病 ⑨制防锈油漆
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
⑵小苏打的成分是NaHCO3,胃舒平中含有难溶性的Al(OH)3,它们都是治疗胃酸过多的药物。写出有关的离子反应方程式:______________________________。胃穿孔患者由于胃酸过多时,医生则禁止其服用小苏打,其原因是__________________________。
 六、(本题包括2小题,共19分)
六、(本题包括2小题,共19分)
31. (9分)如右图是一密闭容器,已知A端盛有2.3g金属钠,B端盛有
xgHgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容
器中的空气成分并未发生变化,求x值。
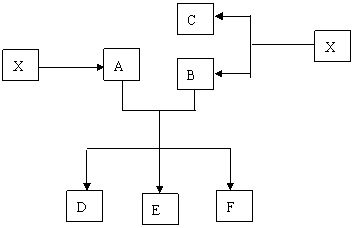
32.(10分)已知X为![]() 和CuO的混合物,取两份等质量的X样品进行下列实验:
和CuO的混合物,取两份等质量的X样品进行下列实验:
 |
|
|
|
|
固体 酸性溶液 无色气体
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为![]() ,溶液E中只含有一种金属离子,气体F在标准状况下体积为
,溶液E中只含有一种金属离子,气体F在标准状况下体积为![]() ,试计算取用的每份X的质量和X中
,试计算取用的每份X的质量和X中![]() 和
和![]() 的质量比。
的质量比。
参考答案
1.B 2. B 3.C 4.D 5.C 6.A 7.C 8.B 9.BD 10.AD [解题思路]根据钠的物理性质和化学性质及碱金属性质的相似性和递变规律分析此题。 解法 A.碱金属在空气中燃烧时,由于其活泼性不同,其产物亦不同。锂燃烧只能生成氧化锂(Li2O),钠燃烧生成Na2O2,钾、铷、铯等燃烧时主要生成更复杂的超氧化物;B.金属锂也很软,可用小刀切割,但比钠费力;C.碱金属单质熔沸点自上而下依次降低;D.锂是最轻的金属(0.534g·cm-3),故不能浸没在煤油中保存。因此选A、D。 [易错点] 碱金属单质性质均很活泼,同学可能误认为它们均可燃烧生成过氧化物而未选A。11. C 12.D 13 .A
14.C [解题思路]因氨水是弱碱,所以在离子方程式中不能写成离子符号,应写成化学式,A错。B产物中还有Cu(OH)2沉淀。C中通入的是过量的CO2,所以溶液是Ca(HCO3)2溶液,C正确。D中通入过量的氢氧化钠溶液化学方程式为:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,离子方程式中应有CO32-,D错 15.D 16.CD 17.D 18.C 19. B 20. A 21. B 22.BD 23.C [解题思路]假设产生11.2L(标准状况)H2,仅由锌、铁、铝、镁四种金属中的一种产生,甴电子得失守恒有Zn~H2 Fe~2H2 2Al~3H2 Mg~H2,可求得m(Zn)=32.5g,m(Fe)=28g m(Al)=9g m(Mg)=12g,这四种金属的质量,只有Al的质量小于10g,其余的均大于10g,故铝是两种金属中必定含有的一种。24. A
翰林汇25.(11分)①无Ag+或SO42-、SO32-、CO32-(2分);②有HSO3-或HCO3-(2分);③可能为CO2气(2分);④原盐为碳酸氢盐(2分);⑤原盐为钠盐(2分);结论:NaHCO3(1分);
26.(8分)(l)B中石灰水变浑浊,说明反应已发生。(2)玻璃管里粉末由红色逐渐变黑,B中溶液出现浑浊。(3)从A逸出的尾气中有未反应完的CO气体,而CO气体点燃时火焰呈浅蓝色。(4)④。 (每线2分)
[解题思路]还原剂CO只要与Fe2O3反应,就会产生CO2,就会使澄清石灰水变浑浊。由于CO气体有毒,不能直接排入大气中,所以应点燃以消除污染,反应结束时还原出的铁单质高温下还可以与O2反应,所以应使Fe在CO的还原性气氛中慢慢冷却,才能防止再被氧化。
27.(10分) (1)A12O3 A1(OH)3 AlC13 NaAlO2
(2)AlCl3+2Na2O2===NaAlO2+O2↑+3NaCl
28.(10分)⑴A.K2CO3 B.KOH C.KHCO3 D.KCl(每线1分,共4分))
⑵2KHCO3![]() K2CO3+CO2↑+H2O K2CO3+
CO2+ H2O ==2 KHCO3
K2CO3+CO2↑+H2O K2CO3+
CO2+ H2O ==2 KHCO3
KOH+ KHCO3== K2CO3+H2O (每线2分,共6分)
29.(8分) 2Na2O2+2C02==2Na2CO2+O2(2分), 2Na2O2+2H20==4NaOH+O2(2分)。 补充适量的水蒸气(2分) 消耗等质量的C02,KO2释放出的O2比Na202更多(2分)。
[解题思路] 过氧化钠可与飞船座舱内的CO2和水蒸气反应:
2Na2O2+2C02==2Na2CO2+O2, 2Na2O2+2H20==4NaOH+O2。
由于人呼出的CO2的质量远大于水蒸气的质量,故先考虑CO2与Na202反应生成O2,由方程式计算知,宇航员呼出1.0kgC02与Na2O2反应,产生的O2为0.36kg,小于宇航员需要消耗的0.9kg氧气,故需通过补充水蒸气,既用于补充所需的氧气,又能维持空气成分的稳定。KO2与CO2的反应方程式为:4KO2+2CO2==2K2CO3+302,可以计算1.0kgCO2与KO2反应生成O2的质
量为1.1kg,可见释放的O2更多。
30. (12分)⑴C(3分)。⑵HCO3-+H+=H2O+CO2↑(3分);Al(OH)3+3H+=Al3++3H20(3分);因服用小苏打会产生大量的CO2气体,会加速胃壁穿孔(3分)。
[解题思路]⑴除①③⑨外,铝均可从口进入人体。能通过口进入人体的铝元素才有可能使人中毒。⑵本题涉及到离子反应与人体内酸碱反应、生化医药问题的综合。
31. (9分)[解题思路] 空气成分未发生改变,表明钠燃烧消耗O2的
质量和HgO分解释放出O2的质量相等。
[解) 设2.3g金属钠燃烧消耗O2的质量为y。
2Na + O2 ![]() Na2O2
Na2O2
46 32
2.3g Y (2分)
![]() 解得y=1.6g。
(2分)
解得y=1.6g。
(2分)
又设质量为x的HgO分解生成1.6gO2。
2HgO![]() 2Hg+O2↑
(1分)
2Hg+O2↑
(1分)
2×216.6 32
x 1.6g (2分)
![]() 解得x=21.66g
解得x=21.66g
答:x值为21.66g (2分)
[易错点]不知道钠在氧气充足时燃烧生成物是Na2O还是Na2O2?
32.(10分) ⑴①![]() (1分),
(1分),![]() (1分) ②
(1分) ②![]() (1分),
(1分), ![]() (1分) ③
(1分) ③![]() (1分),
(1分), ![]() (1分)
(1分)
⑵![]() (1分)
(1分)
![]() ,
, ![]()
![]() (1分)
(1分)
则X质量为![]() (1分),
(1分),![]() 与
与![]() 的质量比为9∶5(1分)。
的质量比为9∶5(1分)。
[解题思路]本题属于无机框图题,要求学生熟悉金属氧化物与酸的反应。金属的冶炼、金属与盐溶液和酸的反应。掌握简单的推论和计算。