高三化学上期练习03
可能用到的相对原子质量:H 1 N 14 O 16 C 12 S 32 Ca 40 Mg 24 Si 28 K 39
Al 27 Na 23 He 4 P 31 Cl 35.5 Ba 137
第 Ⅰ 卷 (选择题 共72分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.翰林1.
同温同压下,同体积的气体单质X2和气体单质Y2化合生成Z,其体积不变,则Z的化
学式为 ( )
A.X2Y2 B.X2Y C.XY2 D.XY
2.下列内容在容量瓶上无需标出的是 ( )
A.刻度线 B.容量标准
C. 温度 D.配制溶液的浓度
翰林汇3.已知Q元素的a、b、c,3种物质的相对分子质量分别为60、90、96。Q元素的质量分数
分别为40%、40%、50%,则Q元素的相对原子质量是 ( )
A.8 B.12 C.24 D.36
翰林汇4.在某温度下,将0.1mol Cl2和0.4mol H2充入2L的密闭容器中,测得其压强为101325Pa,
点火充分反应后再恢复到原温度时,容器的压强为 ( )
A.20265Pa B.60795Pa C.81060Pa D.101325Pa
5.下列叙述正确的是 ( )
A.lmo1 02的质量为32g/mo1
B.NO3-的摩尔质量为62g/mol
C.H2SO4的相对分子质量为98g
D.lmol任何物质的质量等于该物质的相对分子质量
6.由10g不纯的CaCO3和足量盐酸反应在标准状况下,放出2.24L CO2,试推断杂质的组成
( )
A. MgCO3和KHCO3 B.K2CO3和SiO2
C.MgCO3和SiO2 D.无法确定
翰林汇7.在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6mol/L HCl 100mL,使天
平达到平衡。分别向两烧杯中加入不超过5g 的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为 ( )
A. 1:1 B. 24:27 C. 12:9 D. 32:33
8.将50%的硫酸溶液和10%的硫酸溶液等体积混合,所得溶液溶质的质量分数 ( )
A.大于30% B.小于30% C.等于30% D.无法判断
二、选择题(本题包括16小题,每小题3分,共48分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9.翰林9.
物质的量相同的甲烷(CH4)和氨气,一定相同的量是 ( )
A. 质量 B. 体积 C. 质子数 D. 原子数
10.设NA代表阿伏加德罗常数,下列说法中正确的是 ( )
A.23g金属钠变为钠离子时失去的电子数目为NA
B.18g水所含的电子数目为NA
C.8g氦气所含的分子数目为NA
D.16g氧气和16g臭氧(O3)所含的原子数相等。
翰林汇11.下列物质中,含氧原子最多的是 ( )
A. 标准状态时,22.4L的CO2 B.200g 49%的 H3PO4
C. 32g的SO2气体 D. 3.01×1023个O2分子
12. 空气可近似视为N2和O2按体积比为4:1组成的混合气体,则空气的平均相对分子质量约为 ( )
A.28 B.29 C.34 D.60
翰林汇13.甲、乙两种化合物均由X和Y两种元素组成,在甲中X与Y的质量比为3:2,乙中X占质
量的80%,且乙的化学式为X2Y3,则甲的化学式为 ( )
A. X3Y2 B. X2Y5 C. X3Y D.XY4
14.两体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下,两容器内的气体一定具有相同的 ( )
A.原子总数 B.密度 C.分子总数 D.质量
翰林汇15.下列各组物质中,分子数一定相同的是 ( )
A. 11.2 L H2和0.5 mol NO2
B. 2 mol CO和88 g CO2
C. 4℃时,18 mL 水和2×105Pa,27℃时32 g O2
D. 1×105Pa,27℃时22.4 L Cl2和含4mol氧原子的H2SO4
16.CS2(l)能在氧气中燃烧生成CO2和SO2,将0.228g CS2 在448mL(标况)O2中燃烧,将燃
烧后的混合气体恢复到标况时体积为 ( )
A.ll2mL B.448mL C.224mL D.336mL
翰林汇17.2mol/L的稀盐酸与H2SO4各100mL,分别加入等量的Fe粉。反应结束后,产生的气体
质量比为2:3,则向盐酸中加入铁粉的质量是 ( )
A. 8.4g B. 2.8g C. 11.2g D. 5.6g
18.将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的
物质的量浓度是 ( )
A.![]() mol/L B.
mol/L B.
![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.
![]() mol/L
mol/L
19.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是 ( )A.密度比为16∶11 B.密度比为11∶16
C.体积比为16∶1l D.体积比为11∶16
翰林汇20.相对分子质量为m的气态化合物V升 (已换算到标准状况) 溶于Wg水中。得到的溶液
浓度为C%或Mmol/L,密度为d,下列各式中错误的是 ( )
A. M=![]() B. m=
B. m=![]()
C. C%=![]() D. d=
D. d=![]()
翰林汇21.将2.4mol 某金属,投入1.8L 2 mol/L的某酸中,恰好完全反应,并产生7.2g氢气,则
该金属和酸分别是 ( )
A. 二价金属,二元酸 B. 二价金属,三元酸
C. 三价金属,二元酸 D. 一价金属,一元酸
22.翰林23
某元素的醋酸盐的式量为m,相同价态该元素的硝酸盐的式量为n,则该元素的此种化合
价为 ( )
A. (n-m)/3 B. (n-m)/(n+m) C. (m-n)/6 D. (m-n)/3
23.翰林汇今有相同体积的两份植物营养液,其配方如下:
|
序号 | KCl | K2SO4 | ZnSO4 | ZnCl2 |
| (1) | 0.3mol | 0.2mol | 0.1mol | / |
| (2) | 0.1mol | 0.3mol | / | 0.1mol |
两份营养液中各离子浓度 ( )
A. 完全不同 B. 仅c(K+)相同 C. 仅c(Cl-)相同 D. 完全相同
24.某物质A在一定条件下加热分解,产物都是气体。分解方程式为2A![]() B+2C+2D。测
B+2C+2D。测
得生成的混合气体对氢气的相对密度为d,则A的相对对分子质量为 ( )
A.7d B.5d C.2.5d D.2d
第 Ⅱ 卷 (非选择题 共78分)
三、(本题包括2小题,共19分)
25.(5分) 为了配制100mL l mol/L的NaOH溶液,有下列几个操作:① NaOH用纸盛装进行称量;②选刚用蒸馏水净洗过的100mL容量瓶进行配制;③NaOH在烧杯中刚好溶解,即把溶液移入容量瓶;④用蒸馏水洗烧杯内壁两次,洗涤液都移入容量瓶;⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹面恰好与刻度线相切。其中错误的是____________________________________________________________________________ 。
26.(14分)配制约0.1mol/L盐酸溶液500mL,请将操作顺序(1,2,3…)填写在括号里,并在横线上填上适当的仪器名称,操作方法和适当序号。
( )在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅拌,使其混合均匀。
( )在盐酸冷却后,沿________注入_______毫升_______中。
( )用______量取1.19g/cm3,37%的浓盐酸约______毫升注入烧杯中。
( )用适当蒸馏水洗涤烧杯及玻璃棒2~3次,将溶液一并注入容量瓶中。
( )往容量瓶中小心加蒸馏水至液面接近刻度线_______处,改用_______加蒸馏水,使溶液的________与瓶颈刻度相切。
( )采用标准的操作方法摇匀,并转移入试剂瓶中贴上标签。
四、(本题包括2小题,共20分)
27.(8分)在150℃下碳酸铵完全分解成为气态混合物[(NH4)2CO3![]() 2NH3+CO2+H20],该气态混合物密度是相同条件下氢气密度的_______倍。
2NH3+CO2+H20],该气态混合物密度是相同条件下氢气密度的_______倍。
28.(12分)50mL密度为1.84g/cm3、质量分数为98%的浓H2SO4,其物质的量浓度为____;若将50mL该浓H2SO4稀释成密度为1.47g/cm3的溶液100mL,需水 mL
(ρ水=1g/cm3),稀释后溶液的质量分数为________,物质的量浓度为________。
五、(本题包括2小题,共20分)
29.(8分)有一试管,在4℃时,盛满硫酸(密度为1.4g/cm3)其质量是47g,若改盛硝酸溶液(密度为1.2g/cm3)其质量是42g,试管最多能盛水______g。
30.(12分)二氧化碳的摩尔质量是_____,1mol二氧化碳的质量是____,它含有_____个二氧化碳分子;____g二氧化碳中所含的氧原子数与49g H2S04中所含的氧原子数相等。
六、(本题包括2小题,共19分)
31.(9分)100mL某硝酸和硫酸的混合溶液中,加入50mL 4mol/L的NaOH溶液,正好完全中和,然后再取10mL原混合溶液,加入足量BaCl2的溶液,得沉淀1.165g。求:
(1)原混合溶液中H+的物质的量浓度。 (2)原溶液中所含HNO3的质量为多少。
32.(10分)在200℃时将11.6g二氧化碳和水蒸气的混合气体通过足量的Na2O2,反应完全后,固体质量增加3.6g。求混合气体的平均相对分子质量。
参考答案
1翰林汇. D 2.D 3翰林汇.B 4.D
5.D [解题思路]A.lmol 02的质量是32g,而不是32g/mol。B.正确。 C.H2S04的相对分子质量是98,而不是98g。 D.1 mol任何物质的质量并不等同于该物质的相对分子质量,二者数值相等,但单位不同。6. C 7. D
8.A
[解题思路] 通过转向假设方法,改变条件,迅速得出结论。设50%和l0%两种硫酸溶液的密度分别为ρ1和ρ2,并将其进行等质量混合,质量均为m,所得溶液溶质的质量分数为:![]() ×100%=30%。因为对于硫酸溶液而言,浓度越大,密度越大,即ρ1>ρ2,所以两溶液等体积混合时,50%硫酸溶液的质量必大于10%溶液的质量,即混合溶液的质量分数必大于30%,选A。
×100%=30%。因为对于硫酸溶液而言,浓度越大,密度越大,即ρ1>ρ2,所以两溶液等体积混合时,50%硫酸溶液的质量必大于10%溶液的质量,即混合溶液的质量分数必大于30%,选A。
9. C 10.AD [解题思路] 23g钠为1mol,每个钠原子失去1个电子转变成Na+,所以A正确;由于每个水分子含有10个电子,所以18g水所含电子数为1ONA;8g氦气应为2mol,由于氦为单原子分子,所以含有原子数2NA;氧气与臭氧的化学式虽然不相同,但都是由氧原子组成的,所以当氧气和臭氧的质量相同时,所含的氧原子个数一定相同,但氧气和臭氧的物质的量并不相同,D正确。
11. B
12.B [解题思路] Mr(N2)=28,Mr(O2)=32,根据平均值规律,空气的平均相对分子质量![]() r应为:28<
r应为:28<![]() r <32,故选B。也可以根据平均摩尔质量的计算公式:
r <32,故选B。也可以根据平均摩尔质量的计算公式: ![]() =28g/mol×
=28g/mol×![]() +32g/mol×
+32g/mol×![]() =28.8 g/mol,Mr=M mol/g=28.8 g/mol·mol/g=28.8,选B。
=28.8 g/mol,Mr=M mol/g=28.8 g/mol·mol/g=28.8,选B。
[说明] 在化学计算中,一般把空气的平均相对分子质量视为29进行比较和计算,结合气体状态方程推论可知,当某气体Mr>29时,该气体的密度比空气大,当某气体Mr<29时,该气体的密度比空气小。
13. D 14.AC 15. BC 16.B [解题思路]CS2与氧气反应的化学方程式为: CS2(l)+3O2![]() C02(g)+2SO2(g)反应前后气体体积不变,而体积守恒,所以反应前气体体积是448mL,反应后气体体积也为448mL。
C02(g)+2SO2(g)反应前后气体体积不变,而体积守恒,所以反应前气体体积是448mL,反应后气体体积也为448mL。
17.A 18.D [解题思路] 要求溶液的物质的量浓度,需知溶质的物质的量和溶液的体积。溶液的体积不等于HCl(g)的体积,也不等于HCl(g)和H20的体积之和,而要根据溶液的密度求得;
V[HCl(aq)]=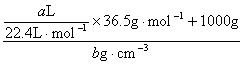
n(HCl)=![]()
c(HCl)=![]() =
=![]() mol·cm-3
mol·cm-3
19.AD [解题思路]同温同压下,气体密度比等于相对分子质量之比:
![]() ,
,
同温同压下,等质量的气体体积比等于相对分子质量的反比,即![]() ,所以本题答案为A、D。 20. AC 21. C 22. A 23.D 24.B [解题思路] 根据题给出的方程式知,完全分解后生成气体的平均摩尔质量
,所以本题答案为A、D。 20. AC 21. C 22. A 23.D 24.B [解题思路] 根据题给出的方程式知,完全分解后生成气体的平均摩尔质量![]() =[M (B)+2M(C)+2M(D)]/5。根据题意
=[M (B)+2M(C)+2M(D)]/5。根据题意![]() =d·M(H2)=d·2g/mol,则M(B)+2M(C)+2M(D)=5
=d·M(H2)=d·2g/mol,则M(B)+2M(C)+2M(D)=5![]() =lOd g/mol。
=lOd g/mol。
又根据质量守恒定律:
2mol·M(A)=1mol·M(B)+2mol·M(C)+2mol·M(D),
所以M(A)=5d g/mol,Mr(A)=5d。
25. (5分) ①、③、⑤。 [解题思路]NaOH易潮解,称NaOH应在小烧杯中称量;溶解NaOH是会放热,要待溶液冷却后,才能转入容量瓶;加蒸馏水至刻度线2~3cm处时要改用胶头滴管加蒸馏水至刻度线。
26. (14分)⑵(1分);⑶(1分),玻璃棒(1分),500mL(1分),容量瓶(1分);⑴(1分)量筒(1分),1.6mL(1分);⑷(1分);⑸(1分)1~2cm(1分),胶头滴管(1分),凹液面(1分);⑹(1分)
27. (8分) 12
28. (12分)18.5mol/L;55,61.3%,9.2mol/L。(每线3分)
29. (8分) 25
30. (12分) [解题思路] 二氧化碳的相对分子质量为44,则它的摩尔质量是些
44g·mol-1,lmol二氧化碳的质量是44g,它含有6.02×1023个C02分子。
设49gH2S04中氧原子的物质的量与xgC02中氧原子的物质的量相等:
![]() ×4=
×4=![]() ×2
×2
x=44
31. (9分)(1)混合酸溶液与NaOH反应的离子方程式为:H-+OH-=H2O,消耗NaOH的物质的量为4mol/L×0.05L=0.2mol,故可知混合溶液中所含的H+的物质的量为0.2mol,故H+的物质的量浓度为c(H+)=![]() =2.0mol/L。(4分)
=2.0mol/L。(4分)
(2)向混合溶液中加入BaCl2后,发生的离子反应为:Ba2++SO42-=BaSO4↓。10mL混合溶液产生1.165g BaSO4沉淀,则可推知原100 mL混合溶液可产生11.65 g
BaSO4沉淀,即![]() =0.05mol,由此可知原溶液中含有H2SO4 0.05mol。0.05mo1 H2SO4可提供0.05mol×2=0.1mol H+,则HNO3提供的H+为0.2mol-0.1mol=0.1mol,即原混合溶液中含有0.1mol HNO3,其质量为0.1mol×63 g/mol=6.3g。(5分)
=0.05mol,由此可知原溶液中含有H2SO4 0.05mol。0.05mo1 H2SO4可提供0.05mol×2=0.1mol H+,则HNO3提供的H+为0.2mol-0.1mol=0.1mol,即原混合溶液中含有0.1mol HNO3,其质量为0.1mol×63 g/mol=6.3g。(5分)
[解题思路]本题是物质的量应用于化学方程式或离子方程式的计算的典型例题,利用物质的量及物质的量浓度进行有关化学方程式的计算,比利用物质的质量进行计算要简便、快速。可以从本题中领悟到物质的量在化学计算中的优越性。
32.(10分)【解题思路】 相对分子质量与摩尔质量在数值上相等,即求每mo1气体的质量: ![]() =11.6÷混合气体总物质的量。
=11.6÷混合气体总物质的量。
方法一:设11.6g混合气体中CO的物质的量为x,水蒸气的物质的量为y。
Na2O2十CO2=Na2CO3十![]() 02
质量增加
02
质量增加
x 0.5x 28g/molx (2分)
Na2O2十H2O=2NaOH十![]() 02
质量增加
02
质量增加
y O.5y 2g/moly (2分)
|
28g/molx十2g/moly=3.6g (2分)
解得:x=0.1mol,y=0.4mol (2分)
混合气体平均相对分子质量=![]() =23.2
(2分)
=23.2
(2分)
方法二:分析下列框图
|
| ||||
|
|
|
|
mg (m+3.6)g
向固体Na2O2中通入11.6g CO2和H2O且完全反应,为何固体只增加3.6 g? 原来是因跑掉02之故。根据质量守恒可知:放出02为11.6-3.6=8g。
所以:0.5(x十y)=![]()
得:x十y=0.5mol
混合气体的摩尔质量=11.6g÷0.5 mol=23.2g/mol 平均相对分子质量为23.2
本题的两种解法虽都属“差量法”,但方法二则更简捷,可以说是“差量法”的经典之作,值得很好体会。
 成分
成分