高三化学试卷(一)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Fe 56 Cu 64 I 127
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.中国科学家在世界上首次发现铂的一种新原子![]() Pt,下列说法不正确的是( )。
Pt,下列说法不正确的是( )。
A.相对原子质量202 B.质量数202 C.原子序数78 D.核内有124个中子
2.室温下某溶液中由水电离出的[OH-]=10-5mol•L—1,则其溶质可能是( )。
A.Na2C03 B.H2SO4 C.NaOH D.CH3COOH
3.在FeCl3,CuCl2,FeCl2混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为( )。
A.2∶l B.1∶2 C. 1∶3 D.1∶4
4.化学实验中常将溶液或试剂进行酸化、碱化,下列处理方法正确的是( )。
A.检验C2H5Cl时,将C2H5Cl和NaOH溶液混合加热后,加入稀H2SO4进行酸化
B.为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
C.鉴定待测溶液中是否含有Fe2+时,用硝酸进行酸化
D.进行乙醛银镜实验时,常在新配制的银氨溶液中滴入少量稀NaOH
5.铅蓄电池效率低、污染大,现在研究用锌电池取代它,其电池反应为:2Zn+O2==2ZnO
其原料为锌、空气和电解质溶液,则下列叙述正确的是( )。
A.锌为正极,空气进入负极反应 B.正极发生氧化反应,负极发生还原反应
C.负极的电极反应是:Zn-2e—+20H—==ZnO+H2O D.电池工作时溶液的pH降低
6.若实行海水淡化供应饮用水,下列方法从原理上分析完全不可行的是( )。
A.加明矾使海水的盐分沉淀而淡化 B.将海水缓慢凝固以获取淡化的饮用水
C.将海水通过离子交换树脂,以除去所含离子 D.利用太阳能将海水蒸馏淡化
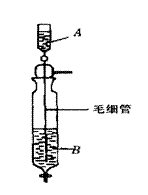 7.如图所示的装置,用以制备某种干燥的纯净气体。
7.如图所示的装置,用以制备某种干燥的纯净气体。
该装置中所装的药品正确的是( )。
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
8.在容积固定的密闭容器中充入一定量的X,Y两种气体,一定条件下发生如下可逆反应并达到平衡: 3X(g)+Y(g)![]() 2Z(g) 正反应是放热反应,测得X的转化率为37.5%,Y的转化率为X的
2Z(g) 正反应是放热反应,测得X的转化率为37.5%,Y的转化率为X的![]() ,下列有关叙述正确的是( )。
,下列有关叙述正确的是( )。
A.若测得X的反应速率为0.2mol•L—1·s—1,则Z的反应速率为0.2mol•L—1·s—1
B.充入氦气,容器压强增大,Y的转化率提高
C.开始充入容器中的X,Y物质的量之比为2∶1
D.升高温度,平衡向正反应方向移动
二、选择题(本题包括10小题,每小题4分,共计40分。每题均有一个或两个选项符合题
意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.已知氯化溴(BrCl)能发生如下反应:①BrCl+H20=HCl+HBrO②nBrCl+2M==MCln+MBrn
下列推断中错误的是( )。
A.BrCl同Br2和Cl2具有相似化学性质
B.BrCl与水反应,它既是氧化剂又是还原剂
C.反应①和反应②中BrCl都没有发生氧化还原反应
D.BrCl的氧化性强于Br2而弱于Cl2
10.维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述中一定错误的是( )。
A. 可与溴水反应
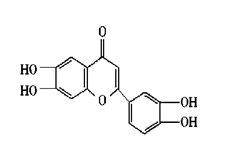 B.可用有机溶剂萃取
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
11.下列分子中所有原子都满足最外层8个电子结构的是( )。
A.六氟化硫 B.三氟化硼 C.光气(COCl2) D.白磷
12.用氨水、苛性钠、盐酸中任何一种溶液作试剂都能被鉴别的溶液组是( )
A.Al(NO3)3和AgNO3 B.Na2CO3和NaCl
C.Fe2(SO4)3和FeCl3 D.NH4HCO3和MgCl2
13.根据“同温同压下气体扩散速率与式量的平方根成反比”的原理,在一根120cm长玻璃管两端分别盛有氨气和氯化氢气体,当两种气体同时扩散,在什么位置相遇而生成白烟( )
A.距氯化氢48.6cm处 B.距氨气48.6cm处
C.距氯化氢71.3cm处 D.距氨气60 cm处
14.下列说法正确的是( )。
A、用结晶法除去硝酸钾中混有的少量氯化钠
B、用湿润的pH试纸测定溶液的pH
C、用点燃的方法除去二氧化碳中混有的少量一氧化碳
D、在氢氧化铁胶体中加入过量的盐酸最终会产生沉淀
15.重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐。下列各组对重铬酸铵受热分解产物的判断符合实际的是( )。
A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O C.CrO3+N2+H2O D.Cr2O3+N2+H2O
16.常温常压下,点燃100LH2S和O2的混合气体,充分反应后恢复到原状况,气体体积变为57L,这57L气体的成分可能是( )。
A.H2S B.SO2 C.SO2、O2 D.O2
17.某白色固体可能由①NH4Cl②AlCl3③NaCl④AgNO3⑤KOH中的一种或几种组成,此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸至过量,有白色沉淀生成,对原固体的判断不正确的是( )。
A. 肯定存在① B.至少存在②和⑤
C.无法确定是否有③ D.至少存在①④⑤
18.当碳、氢、氧、氮等元素的原子量均取整数时,下列说法正确的是( )。
A.![]() —氨基酸的式量均为偶数 B.硝基化合物的式量均为奇数
—氨基酸的式量均为偶数 B.硝基化合物的式量均为奇数
C.烃及烃的含氧衍生物的式量均为偶数 D.酚、醛、羧酸、酯的式量均为偶数
第Ⅱ卷(非选择题 共76分)
三.(本题包括2小题,共22分)
19.(4分)进行下列各项定量试验,由于某步操作不符合要求,可能会造成结果偏低的有(在本题得分范围内选错倒扣分) 。
A.欲取2.0g食盐,用托盘天平(指针向上),称完读数时指针偏向右边
B.用容量瓶配制溶液,摇匀后,发现液面低于刻度线,于是准确地再滴加蒸馏水到刻度线摇匀
C.用量筒量液体,读数时俯视
D.酸式滴定管滴定后读数时俯视
E.测定晶体硫酸铜结晶水含量,加热坩埚蒸发水分,由于温度超过650℃部分晶体由蓝色变为黑灰色。
F.测定硝酸钾溶解度,取10 ml水于试管中,逐渐加入盐搅拌。测量温度时,试管里未见不溶晶体残存。
20.(18分)某学生拟用50 mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量时生成NaHC03,他设计了如下实验步骤:
(a)用25mLNaOH溶液吸收过量的C02气体,至CO2气体不再溶解;
(b)小心煮沸所得溶液1min~2min;
(c)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2C03溶液,并说明理由 。
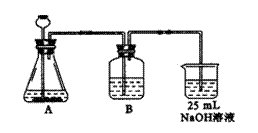
(2)按他的设计,第(a)步实验装置如右图所示。
①装置A使用的试剂是石灰石和盐酸溶液,可否
使用纯碱代替石灰石,并说明原因
。
②装置B使用的试剂是 ,其作用是 。
③为了便于后续实验的煮沸、混合等操作,装NaOH溶液的容器还可使用 。(填仪器名称)
④有人认为将实验步骤(b)(c)的顺序对调,即先混合再煮沸会更合理,你认为对吗?为什么? 。
四.(本题包括2小题,共18分)
21.(9分)从某些方面看,氨和水相当。试回答:
(1)用简要的文字和相应的电离及化学方程式解释,为什么在液氨体系中可用NH4Cl去滴定NaNH2 。
(2)氮可形成多种离子,其中N2H5+,N2H62+是由中性分子结合质子形成的(类似NH4+),因此有类似于NH4+的性质,试写出N2H62+在强碱性溶液中反应的离子方程式:
。
(3)若液态氨相当于地球上的水以满足木星上生物生活的需要,假如那里的生命分子也是以碳链为骨架的话,那么木星上生物体内与地球上生物中葡萄糖的分子结构相当的化合
物是 (写结构简式)。
(4)已知40℃时四种化合物在水中和液氨中的溶解度如下:
溶解度 AgNO3 Ba(NO3)2 AgCl BaCl2
H2O(液) 170g 9.2g 1.5×10-4g 33.3g
NH3(液) 80g 97.2g 0.8g ≈0
上述四种物质在液氨溶液中发生复分解反应的化学方程式为:
。
22.(9分)某中学生取纯净的Na2SO3·7H2O50g,经600℃以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于期望值。经过仔细思考,这位同学解释了这种反常现象,并设计了一组实验,验证了自己的解释是正确的。
(1)他对反常现象的解释是: (用化学方程式表达)
(2)他设计的验证实验是: (请用化学方程式表达)
五.(本题包括2小题,共18分)
23.(9分)已知烯烃、炔烃在臭氧作用下发生以下反应:

![]() CH3—CH==CH—CH2—CH==CH2
CH3CHO + OHC—CH2CHO + HCHO
CH3—CH==CH—CH2—CH==CH2
CH3CHO + OHC—CH2CHO + HCHO

![]() CH3—C≡C—CH2—C≡CH
CH3COOH + HOOC—CH2—COOH + HCOOH
CH3—C≡C—CH2—C≡CH
CH3COOH + HOOC—CH2—COOH + HCOOH
(1)化学式为C10H10的某烃,在臭氧作用下发生反应为:

![]() C10H10
CH3COOH + 3HOOC—CHO + CH3CHO
C10H10
CH3COOH + 3HOOC—CHO + CH3CHO
则此C10H10的结构简式是: 。
(2)有人尝试着合成C10H10稳定的饱和烃,且一氯代物只有一种,你估计若能成功的话,其结构怎样?试用线条表示分子中“碳架”的空间构型(不必写出C、H符号) 。
(3)试推论:如果CnHn的稳定的饱和烃能够合成的话,其空间结构的特点可能是 ;n的最小值为 。
24.(9分)有一种物质A可看作是烃B的所有氢原子被烃C的一价基取代而得。A遇溴水不褪色,A中氢原子被一个氯原子取代只得一种物质;一定量的C完全燃烧,所得的H20和CO2的物质的量的比值为1.25。C的同分异构体不超过2种,而C的二溴代物为3种。一定量的B完全燃烧,生成CO2和H20的物质的量的比值为2。B的相对分子质量大于26,小于78。试回答下列问题:
(1)B的化学式为 。
(2)写出C的3种二溴代物的结构简式: 、 、 。
(3)A的化学式为 ,A的结构简式为 。
六.计算题(本题包括2小题,共20分)
25.(7分)无色的混合气体A,可能含有NO,CO2,NO2,NH3,N2中的某几种。将100mLA气经过如图实验处理,结果得到酸性溶液,而几乎无气体剩余。
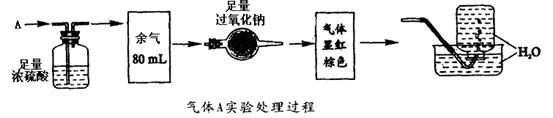
(1)A气体的组分各是什么?(答错倒扣分)
(2)推算各气体的体积,并简述推算的依据。
26.(13分)将1LC3H8和aL氧气混合后点燃,燃烧后测得混合气体的体积为bL,使其通过足量的碱石灰后气体的体积变为c L,令x=b-c。(气体体积均在1.01×105Pa,120℃时测得,假设H原子燃烧只生成水)。
(1)试讨论x的值与c L气体的成分,并将讨论结果填入下表中(不一定填满)。
| 编 号 | X的取值范围 | C L气体的可能成分(写化学式) |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | ||
| ⑥ |
(2)当x=5时,计算出a的值(要有推理、计算过程)
参考答案:
一.选择题
1.A 2.A[提示:水解的本质是生成弱电解质,促进水的电离] 3.C
4.D[提示:SO42—会干扰Cl—的检验,故A不对;盐酸是还原性酸,不能对高锰酸钾进行酸化,故B不对;硝酸会将Fe2+氧化,故C不选;银镜反应必须是在碱性条件下进行,故D符合题意]
5.C 6.A[提示:加明矾生成胶体只能使浊液杂质沉淀,不能使溶质沉淀分离出来]
7.B[提示:毛细管可以使溶液直接深入到B装置的溶液最底部,以便于洗气干燥]
8.C
二.选择题
9.BC
10.C[提示:维生素P的中间环不是苯环,是由酮、醚的结构共同组合而成的]
11.CD 12.AD
13.A[提示:氨气的扩散速度较快,则相遇必定是在靠近氯化氢处]
14.A
15.D[提示:重铬酸根离子是一种常见的氧化剂,铬由+6价降为+3价]
16.AC
17.B[提示:因为加稀硝酸过量有白色沉淀,则必有④,必无②,则原来澄清溶液呈碱性,则是银氨溶液,所以必有①④⑤]
18.CD
三.
19.A,D,E(全对给4分,错1个扣1分,少答1个扣1分)
20.(1)能;因为NaHCO3+NaOH==Na2CO3+H2O(4分)
(2)①不行 粉末纯碱代替块状石灰石,使得生成气体的速度较快,不利于碱充分地吸收CO2。(4分)
②饱和NaHCO3溶液 除去CO2中混有的HCl,以避免有NaCl生成影响实验。(4分)
③锥形瓶(其它合理答案均给分,2分)
④不对 若不先煮沸以赶净CO2,则另一半的NaOH就会与之反应,从而不能完全将NaHCO3转化Na2CO3,实验就失败了。(4分)
四.
21.(1)液氨中存在着2NH3![]() NH4+
+ NH2—电离平衡,据勒沙特列原理,反应NaH+NH4Cl==NaCl+2NH3在液氨中能发生。(3分)
NH4+
+ NH2—电离平衡,据勒沙特列原理,反应NaH+NH4Cl==NaCl+2NH3在液氨中能发生。(3分)
(2)N2H62++2OH—==N2H4+2H2O(2分)
(3)CH2NH2(CHNH2)4CH=NH(2分)
(4)在液氨中:Ba(NO3)2+2AgCl==2AgNO3+BaCl2↓(2分)
22.(1)4Na2SO3===Na2S+3Na2SO4(给3分)
(2)若Na2SO3完全转化为Na2SO4和Na2S,则分别检验出SO42-、S2-即可(合理均给分,给
3分);若Na2SO3未完全转化为Na2SO4和Na2S,则可加入盐检验出S2-,同时专门检验SO42-。(给3分)
五.
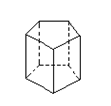 23.(1)CH3—C≡C—CH==CH—C≡C—CH==CH—CH3(2分)
23.(1)CH3—C≡C—CH==CH—C≡C—CH==CH—CH3(2分)
(2) (3分,凡不对称的结构均适当扣分)
(3)每个C形成三个C—C单键,1个C—H键,且成对称结构,保持其稳定状态。
6(4分)
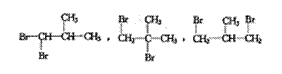
24.(1)C4H4 (2分) (2) (各给1分)
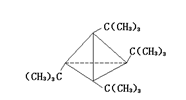
(3)C20H36(2分) C4[C(CH3)3]4(2分)
六.
25.(1)NH3,NO,CO2(每个1分,答错则倒扣分,不出现负分)
(2)①A气体无色,故不含NO2,只有NH3被浓硫酸吸收,V(NH3)=100-80=20ml(1分)
②通过Na2O2后出现红棕色,说明原气体中含有NO,并与新生成的O2反应生成NO2。O2是CO2与Na2O2反应生成的。(1分)
③当NO2与O2按4∶1通入水中则全部生成HNO3。故V(NO)=32 ml
V(CO2)=48 ml(2分)
26.(1)
| 编 号 | X的取值范围 | CL气体的可能成分(写化学式) |
| ① | 0<X<4 | C3H8、CO |
| ② | X=4 | CO |
| ③ | 4<X<7 | CO |
| ④ | X=7 | 无气体或O2 |
| ⑤ | ||
| ⑥ |
(每空2分,共计8分)
(2)(5分)∵当X=5时,根据上述表格可知,燃烧产物是CO、CO2、H2O。
又∵1升C3H8燃烧生成水为4升
∴V(CO2)=5-4=1
V(CO)=3-1=2
∴C3H8燃烧的化学方程式为
![]() C3H8 + 4O2 2CO + CO + 4H2O
C3H8 + 4O2 2CO + CO + 4H2O
∴a=4