高三化学第一次考试
化 学 试 题
2004.8.25.
可能用到的原子量: H-1 N-14 O-16 Na-23 S-32 Cu-64
一、选择题(每小题只有一个正确答案,每题3分,共24分)
1.下列叙述中,不正确的是
①原子晶体中只含有极性键 ②金属在常温时都以晶体形式存在
③离子晶体一定含离子键,也可能有共价键 ④分子晶体中一定有分子间作用力,有的还可能有氢键
A.①④ B.②③ C.①② D.①③
2.下列说法中正确的是( )
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C. 金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2与SiO2都是分子晶体,所以它们有接近的熔、沸点
3.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C. 核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
4.已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2(g); △H=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2(g); △H=-395.41 kJ·mol-1
据此判断,下列说法正确的是
A.由石墨制备金刚石中吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石中吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石中放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石中放热反应;等质量时,石墨的能量比金刚石的高
5.已知(1)H2(g)+1/2O2(g)===H2O(g); △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g); △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l); △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l); △H4=d kJ·mol-1
下列关系式中正确的是: A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
6. 在[HCO3-]=0.1mol/L的溶液中,可以大量共存的离子组是
A. Al3+、NO3-、NH4+、Cl- B. Na+、SO42-、K+、CH3COO-
C. AlO2-、K+、Na+、NO3- D. Na+、NO3- 、K+、ClO-
7.pH=2的某溶液中含有大量的 Fe2+、Fe3+、Mg2+、NH4+,则此溶液中还可以大量存在的离子可能有:A. SO42- B、CO32- C、NO3- D 、SCN-
8.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm之间 B. 能透过半透膜
C. 加热蒸干、灼烧后都有氧化铁生成 D. 呈红褐色
二、选择题(每小题有1-2个正确答案,只选一个选项且正确的得
2分,多选、错选不得分。每题5分,共50分)
9.在xR2++yH++O2=mR3++nH2O的离子方程式中,对系数m和R3+判断正确的是 A. m=4,R3+是氧化产物 B. m=y,R3+为氧化产物
C. m=2,R3+是还原产物 D. m=y,R3+为还原产物
10.Na3N是离子化合物,它能与水反应生成氨气。
以下关于Na3N的说法中正确的是:A.Na3N与盐酸反应时生成两种盐
B.在Na3N与水反应中Na3N是还原剂
C. Na3N分子中Na+的半径比N3-的半径小
D.Na+ 与 N3-的电子层都与氩原子的结构相同
11.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的
反应如下:①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO
下列叙述中正确的是 :A. 在反应①中,ZnI2既是氧化产物又是还原产物
B.在反应①中,ZnCl2既是氧化产物又是还原产物
C.在反应②中,ICl既是氧化剂又是还原剂
D. 在反应②中,ICl既不是氧化剂,又不是还原剂
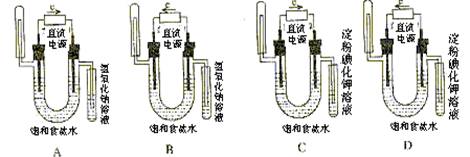
12.下图中验证氯化钠溶液(含酚酞)电解产物的装置(惰性电极)是
13.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4,当在醋酸铅(Pb(Ac)2)溶液中通入弱电解质H2S时,有黑色沉淀PbS生成.表示这个反应的离子方程式正确的是
A.Pb(Ac)2+H2S=PbS↓+2HAc B.Pb2++H2S=PbS↓+2H+
C.Pb2++2Ac-+H2S=PbS↓+2HAc D.Pb2++2Ac-+2H++S2-=PbS↓+2HAc
14.NH3、H2S是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。
据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子 B、在ABn分子中A原子没有孤对电子
C.在ABn分子中A的相对原子质量小于B的相对原子质量
D.分子中每个共价键的键长应相等
15、某温度下,将CO2和CO按1﹕3的比例混合后,充入一体积不变的容器中,测得压强为P,然后投入足量的过氧化钠,在电火花作用下充分反应至完全,恢复到原来的温度,如不计固体物质的体积,容器中的压强为:
A、P B. ![]() P C、
P C、![]() P D、
P D、![]() P
P
16.将溶质的质量分数为a%、物质的量浓度为c1mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为c2mol/L.则c1和c2的关系是
A.c2=2c1 B.c2<2c1、 C、c2>2c1 D.c1=2c2
17.现有m1 g KCl饱和溶液,其溶质的质量分数为c1%,对其采取某种措施后析出m g KCl晶体,母液质量为m2 g,其溶质的质量分数为c2%,则下列关系中正确的是
A.c1一定大于c2 B. 原条件下KCl的溶解度小于c1 g
C.m1-m2≤m D、m1c1-100m=m2c2
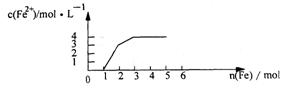 18.某稀溶液中含有Fe(NO3)3 、 Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
18.某稀溶液中含有Fe(NO3)3 、 Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
A.1:1:1 B.1:3:1 C.3:3:8 D、1:1:4
三、填空题:
19.(本题10分)我国工业上制硫酸的主要含硫原料是
(写名称和化学式;理论上还可以有其它含硫原料),所需的设备为 、
、 。由于水和三氧化硫反应放出大量的热使水汽化而形成酸雾不利于三氧化硫的吸收,因此用浓度为 的浓硫酸吸收。
20.(本题4分)已知:3Br2+6FeCl2=4FeCl3+2FeBr3,则112mL Cl2(标准状况)通入10mL 1 mol/L的FeBr2液中,发生反应的离子方程式是
21.(本题10分)配平下列反应方程式,并标出电子转移的方向和数目。
(1)( )![]() ( )
( )![]() ( )
( )![]() ( )
( )![]()
(2)如氨气和二氧化氮共1.5mol,且氧化产物比还原产物的质量多2.8克,
 则:二氧化氮物质的量为__________或__________.
则:二氧化氮物质的量为__________或__________.
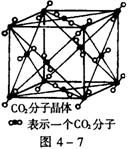
22.(本题8分)(1)图4-7为CO2分子晶体结构的一部分。
观察图形,试说明每个CO2分子周围
有______个与之紧邻等距的CO2分子;
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由
高到低排列的顺序是______>______>______
(填写相应物质的编号)。
23.(本题8分)由稀有气体元素Xe(氙)形成的一种化合物XeO3极不稳定。将适量的XeO3投入30mL0.1mol·L-1含Mn2+的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56mL。则:
(1)有关反应现象:________________________。
(2)若XeO3是分子晶体,写出反应的离子方程式:________________。
24.(本题9分)在氯酸钾的分解反应里,二氧化锰的催化问题到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下:
Ⅰ:2KClO3+2MnO2![]() 2A+B↑+C↑ Ⅱ.2A
2A+B↑+C↑ Ⅱ.2A![]() D+MnO2+C↑
D+MnO2+C↑
![]()
(1)反应Ⅰ中氧化产物是(填化学式)____________。
(2)反应Ⅲ的化学方程式为______________________________。
(3)按上述反应过程,若制取1.5mol氧气,总共有______mol电子发生转移。
25.(本题12分)氯化银、氢氧化银都能和氨水反应生成Ag(NH3)2+,Ag(NH3)2+能和H+反应:Ag(NH3)2+ + 2H+= Ag+ + 2NH4+,今有一白色固体可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的两种或三种组成的,为了确定该白色固体的成分,进行以下实验:
(1)取白色固体少许,加入适量蒸馏水,充分振荡得无色溶液;
(2)取(1)得到的溶液少许,滴加适量的硝酸,有白色沉淀生成。
则此白色固体必须含有的物质可能有两种组合:
第一种是NH4Cl 、______________。第二种是 ___________。
在第一种情况下加入足量的稀硝酸时仍有白色沉淀,该白色沉淀是______。
在第二种情况下加入稀硝酸时也产生白色沉淀,其离子方程式为 __________。
26.(本题15分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
现向含有lmolKI的硫酸溶液中加入含a molKBrO3的溶液,a的取值不同,
所得产物也不同。
(1)试将讨论的结果填入表中:
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① |
| I2 、、Br- |
| ② | 1/6 < a < 1/5 |
|
| ③ |
| I2、、IO3-、、Br2 |
| ④ | a ≥ 6/5 |
|
(2)对表中③组:当n(I2) = n(IO3-)时,求a的值。
| 班级_________姓名_________________考 试 号_________ ______
密 封 线 内 不 得 答 题 ………………………………………………………密…………………………封…………………………线……………………………………………… |
高三第一次考试
化 学 答 题 卡
一、 二、选择题( 共74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、 填空题:25、
_______ __, 、 、 ___ __, 。
20.
21、
(1)( )![]() ( )
( )![]() ( )
( ) ![]() ( )
( )![]()
(2)二氧化氮物质的量为__________或__________.
22. (1) (2)______>______>______
23.(1)有关反应现象:___________________ _____________。
(2) 离子方程式:______________ __。
24.(1)反应Ⅰ中氧化产物是(填化学式)____________。
(2)反应Ⅲ的化学方程式为______________________________。
(3) 若制取1.5mol氧气,总共有______mol电子发生转移。
25.第一种是NH4Cl 、____________________________。
第二种是 __________________________________。
在第一种情况的白色沉淀是___________________。
在第二种情况下离子方程式___________。
26.(1)
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① |
| I2 、、Br- |
| ② | 1/6 < a < 1/5 |
|
| ③ |
| I2、、IO3-、、Br2 |
| ④ | a ≥ 6/5 |
|
(2)
高三第一次考试
化 学 参 考 答 案
一、二、选择题( 共74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
| 答案 | C | C | C | A | C | B | A | C |
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AB | AC | AD | D | A | B | B | C | D | D |
三、填空题:25、(2分×5=10分)
_黄铁矿FeS2、硫磺S_, 沸腾炉 、接触室 、_吸收塔_, 98.3% 。
20.( 4分) Cl2+2Fe2+=2Cl- +2Fe3+
21、 ( 配平3分、电子转移3分、二氧化氮物质的量为4分,共10分)
(1)( 8 )![]() (6)
(6)![]() (7)
(7) ![]() (12 )
(12 )![]()
(2)二氧化氮物质的量为___0.6_mol_或_0.7_mol_.
22. (4分×2=8分)(1) 12 (2)_③__>__②___>__①___
23.(4分×2=8分)
(1)有关反应现象:__溶液变为紫色_,有气体产生__。
(2) 离子方程式:_5XeO3 + 6Mn2+ + 9H2O = 5Xe + 6MnO4- + 18H+__。
24.( 4分 + 3分 + 2分=9分)
(1)反应Ⅰ中氧化产物是(填化学式)_KMnO4__、_O2___。
(2)反应Ⅲ的化学方程式为___Cl2 + K2MnO4 = 2KCl + MnO2 + O2↑__。
(3) 若制取1.5mol氧气,总共有_6__mol电子发生转移。
25.( 4×3分 = 12分)
第一种是NH4Cl 、___KOH 、 AgNO3____。
第二种是 _Al2(SO4)3 、 KOH____。
在第一种情况的白色沉淀是___AgCl__。
在第二种情况下离子方程式__AlO2- +H+ + H2O = Al(OH)3↓_。
26.(1)4×3分 = 12分
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| ① | 0 < a ≤ 1/6 | I2 、、Br- |
| ② | 1/6 < a < 1/5 | I2 、Br2、、、 Br- |
| ③ | 1/5 ≤ a < 6/5 | I2、、IO3-、、Br2 |
| ④ | a ≥ 6/5 | IO3- 、Br2 |
(2)( 3分 ) a = 8/15