高三化学第一次月考试题1
可用到的相对原子质量:H-1,N-14,O-16,Na-23,Al-27,Fe-56,Cu-64
第Ⅰ卷
一、 选择题(每题4分,共48分,每小题只有一个答案符合题意)请把答案填在第4面答题纸的表格内。
1.据报道,月球上有大量3He存在,以下关于3He的说法正确的是
A.是4He的同分异构体 B.比4He多一个中子
C.是4He的同位素 D.比4He少一个质子
2.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
3.CaH2常作生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O====Ca(OH)2+2H2↑ 其中水是
A.还原剂 B.氧化剂
C.既是还原剂又是氧化剂 D.既不是氧化剂又不是还原剂
4.下列物质的熔沸点高低顺序正确的是( )
A、金刚石>水银>氧化铝>碳化硅 B、CI4>CBr4>CCl4>CH4
C、H2Se>H2S>H2Te>H2O D、金刚石>生铁>纯铁>钠
5、今有三个氧化还原反应:
①2FeCl3+2KI=2 FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不氧化Fe2+和Cl-。可加入的试剂是A.Cl2 B.KMnO4 C.FeCl3 D.HCl
6.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
7.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是
A.CuSO4 B.NaCl C.BaCl2 D.H2SO4
8.将适量的铁粉放入三氯化铁(FeCl3)溶液中,完全反应后,溶液中的Fe3+和Fe2+物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是:
A. 2:3 B.
3:2 C.
1:2 D.
1:1
二、选择题(每题4分,共48分,每小题只有一或两个答案符合题意)请把答案填在第4面答题纸的表格内。
9、设NA为阿佛加德罗常数,下列叙述中正确的是
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
10.NH4ClO4加热至483K时,可完全分解成N2,Cl2,O2和H2O,则反应中氧化产物的总物质的量与还原产物的总物质的量之比是
A.3∶1 B.2∶1 C.1∶3 D.1∶1
11.允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A.NH3•H2O B.NaOH C.AgNO3 D.BaCl2
12、若向无色溶液中加入铝粉,反应后生成氢气,则原溶液中肯定不存在的离子组是
A、Cl—、NO3—、Mg2+、K+ B、NH4+、Cl—、Na+、Ba2+
C、SO42—、Cl—、CO32—、Na+ D、SO42—、K+ 、NH4+、SO32—
13.用48mL0.1mol/L的FeSO4溶液,恰好还原2.4×10-3mol[RO(OH)2]+离子,则R元素的最终价态为
A.+6 B.+5 C.+4 D.+3
14.下列各组溶液不加任何试剂就能鉴别的是( )
A.盐酸、氢氧化钠、酚酞 B.氢氧化钠、氢氧化钡、硫酸
C.硫酸、碳酸钠、氢氧化钠 D.硫酸铜、盐酸、硫酸
15.下列离子方程式中正确的是
A.硫化亚铁放入盐酸中 S2- + 2 H+ = H2S ↑
B.硫酸铜溶液中通入硫化氢 Cu2+ + H2S = CuS↓ + 2 H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4NH3•H2O = AlO2- + 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3—+ OH— = CO32— + H2O
16、CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
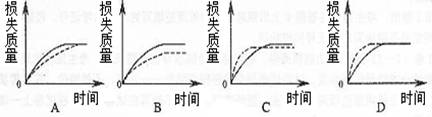
17.将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是
18、在某100ml混合液中,HNO3和H2S04的物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1. 92g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L—1)是( )。
A.0.15 B.0.225 C.0.35 D.0.45

选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | ||||||||||
第Ⅱ卷
三、
19.下列操作或发生事故时的处理方法正确的是________(填字母)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH值
B.称量一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线.
D.浓![]() 不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
E.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
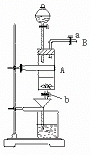 20.三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
20.三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体。
填写下列空白:
(1)从B导管收集产生的气体可采用的方法是 。
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
(3)烧杯内放过量稀HNO3的原因是 ,离子方程式是 。
(4)整个实验过程中,弹簧夹a都必须打开,除了为排出产生的气体外,另一个目的是 。
(5)用降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是 。
四、
21.某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
⑴该反应的氧化剂是
⑵如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在下面的化学式上用单线桥法标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
⑶如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
22. 在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,产生大量的水蒸气和氮气同时放出大量的热。已知0.4mol液态肼与足量的H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量。
(1)写出此反应的热化学方程式 。
(2)已知H2O(l)=H2O(g);△H=+44KJ/mol,则16g液态肼与足量液态H2O2反应,生成氮气和液态水时,放出热量为 KJ。
(3)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个突出优点是 。
五、
23.(13分)现有A、B、C、D、E五种盐溶液,分别由K+、NH![]() 、Ag+、Ba2+、Al3+、Cl-、Br-、CO
、Ag+、Ba2+、Al3+、Cl-、Br-、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的阳离子和阴离子各一种组成 (五种盐所含阴、阳离子各不相同)。已知:
中的阳离子和阴离子各一种组成 (五种盐所含阴、阳离子各不相同)。已知:
![]()
![]()
![]()
![]() ①A+B 白↓②A+C 白↓③A+D 白↓④B+C 白↓和一种气体⑤A的溶液呈中性⑥B的溶液中c(OH-)>c(H+)
①A+B 白↓②A+C 白↓③A+D 白↓④B+C 白↓和一种气体⑤A的溶液呈中性⑥B的溶液中c(OH-)>c(H+)
(1)C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用化学式表示)A ,B ,C ,D ,E 。
(2)写出下面各步反应的离子方程式:
①
②
③
④
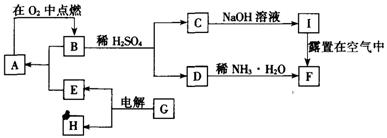 24.单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
24.单质A在适宜条件下有如图所示的一系列转化,其中F是一种红褐色物质。试解答下列各题:
(1)写出下列物质的化学式:A ,B 。
(2)用化学方程式表示下列转化过程
B+H2SO4→C+D:___________________________ 。
I露置在空气中转化为F:___________________________ 。
(3)G可能是_________或_________;每生成1molE同时生成与其对应H的物质的量是 _________ mol或_________mol。
六、
25、把0.69gNa投入500mL0.1mol/L的AlCl3溶液中,有0.78g白色沉淀生成,再投入多少克Na可使沉淀恰好完全溶解?
26、现有由某种铁的氧化物与适量铝粉均匀混合而成的混合物,等分成两份后,一份与足量的NaOH溶液反应放出H2 a g,一份隔绝空气加热,铝粉恰好完全反应,将反应所得固体与足量盐酸反应,放出H2 b g。
(1)与NaOH反应时,氧化剂是 ,与盐酸反应时还原剂是 .
(2)若a∶b=1∶1,则铁的氧化物的化学式为 .
(3) a∶b=4∶3,则铁的氧化物与铝粉反应的化学方程式为(标出电子转移的方向和数目)
。
之下)、用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水配成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录如下表:
| 实验次数 | 称取样品质量/g | 所加Ba(OH)2溶液体积/L | 测得生成沉淀质量 |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
回答下列问题:
(1)第二次实验中产生沉淀质量是多少克,请将结果填在表格相应的空格中。
(2)样品中NaHCO3和K2CO3的物质的量之比是 .
(3)室温下取第3组实验所得溶液体积的1/10,加水配成500ml溶液,求稀释后溶液的PH(写出计算过程)。
已知25℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因而pH增大。你认为上述解释中 (“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若 (填“甲”或“乙”)的解释正确,溶液的pH应 (填“增大”“减少”或“不变”)。
17.将![]() 逐渐加入到含有
逐渐加入到含有![]() 、
、![]() 、
、![]() 的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入
的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入![]() 的物质的量(mol)的关系如图所示,则原溶液中
的物质的量(mol)的关系如图所示,则原溶液中![]() 、
、![]() 、
、![]() 的物质的量分别为( ).
的物质的量分别为( ).
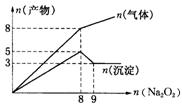
A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol D.3 mol、2 mol、4 mol
19.下列操作或发生事故时的处理方法正确的是________(填字母)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH值
B.称量一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线.
D.浓![]() 不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹3%-5%的小苏打溶液
E.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
13.下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:
![]()
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
(1) A是_______________,Y是______________,Z是_____________。
(2) 当X是强碱时,E是_______________,当X是强酸,E是____________。
(3) 写出A与X反应的离子方程式:
①_______________________________________________;
②_______________________________________________。