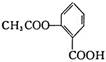
高三化学第一次月考试题2
说明:1.本卷分I卷(选择题)和第Ⅱ卷(非选择题),共20小题。
2.本卷限时100分钟,满分110分。
3.可能用到的无素相对原子质量为:H—1 C—12 N—14 O—16 Cl—35.5 Na—23 K—39 Cu—64 Fe—56 Ag—108
4.答案做在答题卷上。
5.命题人:蔡中华
第I卷(选择题 共64分)
一、(本题包括16个小题,每小题只有一个选项符合题意。每小题4分,共64分)
1.某气体在接近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该
气体是 ( )
A.O3 B.CO C.SO2 D.CCl2F2
2.科学家制咸了一种耐高温、高强度的材料氮化硅,它的化学式可能是 ( )
A.SiN B.Si3N4 C.Si2N3 D.Si4N3
3.中美学者共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成,关于此物质,下列说法错误的是 ( )
A.属于烃类化合物 B.比金刚石的硬度要小
C.在常温下呈气态 D.能在空气中燃烧
4.下列物质按“赤、橙、黄、绿、蓝、紫”的颜色顺序编排的是 ( )
①溴水 ②CuSO4 ③KMnO4 ④CuO ⑤AgI ⑥FeSO4·7H2O
⑦CuSO4·5H2O ⑧Fe2O3 ⑨Ag2S
A.①②③④⑤⑥ B.③④⑤⑥⑧② C.⑧①⑤⑥⑦③ D.⑧⑨⑤⑥②③
5.设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.金属钠与水反应,失去NA个电子
B.常温常压下,1mol氯气与足量金属镁反应,转移2NA个电子
C.标准状况下,aLCH4和aLC6H14中所含分子数均为aNA/22.4
D.在20℃,1.01×105Pa时,2.8gC2H4和CO的混合气体,含气体分子数小于0.1NA
6.氯磺酸(ClSO3H)是一元强酸,它能与甲酸发生反应:HCOOH+ClSO3H→CO+HCl+H2SO4,下列说法正确的是 ( )
A.反应后溶液的酸性增强 B.ClSO3H被还原
C.HCOOH是还原剂 D.ClSO3H是离子化合物
7.下列离子方程式正确的是 ( )
A.明矾溶液中加放过量的氨水Al3++4OH-==AlO2-+2H2O
B.漂白粉溶液中通入过量的二氧化碳 Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO+CO32-
C.FeBr2溶液中加入过量的氯水 2Br-+Cl2==Br2+2Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-==CaCO3↓+2H2O+CO32-
8.密度为d g / cm3的盐酸中,逐滴滴入硝酸银溶液,直至沉淀完全为止,已知沉淀的质量和原盐酸溶液的质量相等,则原盐酸的物质的量浓度(mol / L) ( )
A. 25.4 d B. 12.7 d C. 6.97 d D. 6.35 d
9.配制200mL0.100mol/L盐酸溶液时,下列实验操作使得所配的溶液浓度偏大的是( )
A.且量筒量取所需的浓盐酸时俯视读数
B.用量筒量取的浓盐酸倒入烧杯后,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中
C.定容时,仰视标线
D.定容后倒转容量瓶数次摇匀,发现液面最低点低于标线,再补加几滴蒸馏水至标线
10.下列事故的处理正确的是 ( )
A.误食氯化钡溶液,应立即服用大量硫酸铜溶液解毒
B.金属钾失火时,应立即用水扑灭
C.实验中不慎打翻酒精灯,就立即用大量水将其冲灭
|
11.阿斯匹林简称APC,其结构为 在一定条件下,阿斯匹林可发生的反
应有:①中和反应 ②银镜反应 ③水解反应 ④酯化反应 ⑤加成反应 ⑥消去反应。正确的组合是 ( )
A.①②③⑥ B.②④ C.①③④⑤ D.③④⑥
12.在中性无色溶液中,能大量共存的离子组是( )
A..NO3―、HCO3―、 K+ 、Na+ B.CO32― 、Ba2+ 、Cl― 、K+
C. Cu2+ 、HCO3― 、SO42― 、K+ D..Fe3+ 、Cl、 NO3― 、Al3+
13.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
14.将某温度下的KNO3溶液190g蒸发掉10g水恢复到原温度,或向其中加入5gKNO3固体,可使溶液达到饱和,则该温度下KNO3溶解度是 ( )
A.1g B.50g C.90g D.100g
15.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2 a = b,则下列推断正确的是(氨水的密度比纯水的小)( )
A.2ω1 > ω2 B. 2ω2 =ω1 C.ω2 > 2ω1 D.ω1 < ω2 < 2ω1
16.在一定条件下,CO和CH4燃烧的热化学方程式分别为 ( )
2CO(g)+O2(g)==2CO2(g) ; △H=-566kJ·mol-1
CH4(g)+2 O2(g)==CO2(g)+2H2O(1) ; △H=-890kJ·mol-1
由等物质的量的CO和CH4的混合气体共4mol,在上述条件下完全燃烧时释放的热量为
A.1173kJ B.1456kJ C.2346kJ D.1780kJ
第Ⅱ卷(共46分)
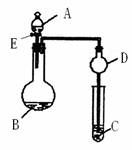 17.(11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
17.(11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 .
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸
(H2S)饱和溶液,旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,
旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出该反应的化学方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为 。
(5)该题图示装置有多种用途,请举一例(除题中之外)填空:A为 ,B为 ;C中盛 ,其目的为 。
18.(12分)、近年来发现许多生物体组织中存在的少量NO有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点。请回答问题:
(1)NO在大气层中可发生反应:NO+O2 ![]() NO2 +
O,NO2 + O
NO2 +
O,NO2 + O![]() NO + O2 ,从反应最终结果看,NO是一种 (填序号)。
NO + O2 ,从反应最终结果看,NO是一种 (填序号)。
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物 E.催化剂
(2)将NO转化为无毒气体,可选用NH3在400℃左右并有催化剂存在下把NO还原为氮气和水,写出该反应的化学方程式。相同条件下能否用天然气代替NH3来处理硝酸尾气 (NOx)。如果可能,请写出能发生反应的化学方程式,并指出是否具有实际意义。
(3)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+与亚硝酸根离子在酸性水溶液中反应的离子方程式 。
(4)把NO气体压缩到1.01×107Pa,再加热到一定温度,发现气体的压力迅速下降,压力降至略小于原压力的2/3,然后压力就不再改变,已知其中一种产物为N2O,则上述变化的化学方程式为 ; 。所得混合气体的平均摩尔质量M的取值范围应该是 。
19.(14分)某校化学兴趣小组的同学欲测定某种品牌精中食盐的含量。
下面是该小组所做的有关实验步骤:
①称取某牌袋装味精样品10.0g放入烧杯中,并加适量蒸馏水溶解;
② ;
③ ;
④用蒸馏水洗涤沉淀2—3次;
⑤将沉淀烘干、称量,测得固体质量4.90g
根据上述实验步骤回答下列问题:
(1)补齐所缺少的实验步骤:② ③
(2)实验步骤③所用的玻璃仪器有 ;
(3)检验沉淀是否洗净的方法是: ;
(4)烘干沉淀应采取的方法是 。
(5)若味精标签上标注:“谷氨酸钠含量≥80.0%,NaCl含量≤20.0%,则此样品是否合格?
(填“合格”,“不合格”)
20.(9分)在100mL 36.5%的浓盐酸(密度为1.18g/cm3)中加入多少mL 2mol/L的稀盐酸(密度为1.08g/cm3),才能配成6mol/L的盐酸(密度为1.10g/cm3)。(要求先计算再简答配制的步骤)
参考答案及评分标准
一、1. A 2. B 3. C 4. C 5. B 6. A 7. D 8. C 9. B 10. D 11. C 12. A 13. B 14. B 15. C 16. C
二、
17.(11分)
(1)防止倒吸(1分)
(2)溶液变浑浊(1分);2H2S+O2====2S↓+2H2O(1分)
(3)溶液变蓝色(1分);I2+5Cl2+6H2O====2HIO3 + 10HCl(1分)
(4)有白色胶状沉淀(1分);Al3++3NH3·H2O====Al(OH)3↓+3NH4+(1分)
(5)A.稀硫酸(1分); B.硫化亚铁(1分); C.硫酸铜溶液(1分);验证硫化氢气体的产生(1分)(答案不唯一,酌情给分。)
18.(12分)
(1)E (2分)
| |||
| |||
![]() (2)6 NO + 4NH3
5N2 + 6H2O ,能 ,x CH4 + 4NOx
(2)6 NO + 4NH3
5N2 + 6H2O ,能 ,x CH4 + 4NOx ![]() x CO2
+ 2N2 + 2x H2O ,天然气比NH3易得,且价格便宜。用天然气代替NH3具有实际生产价值。(4分)
x CO2
+ 2N2 + 2x H2O ,天然气比NH3易得,且价格便宜。用天然气代替NH3具有实际生产价值。(4分)
(3)NO2- + Cu+ + 2H+ = NO↑ + Cu2+ + H2O (2分)
(3)3NO = N2O
+ NO2 ,2NO2 ![]() N2O4
,45g /mol < M <
60g/mol (4分)
N2O4
,45g /mol < M <
60g/mol (4分)
19.(14分)
(1)②加入硝酸酸化的硝酸银溶液于样品溶液中,直到不再产生沉淀为止(3分);
③过滤(2分)
(2)漏斗、玻璃棒、烧杯(2分)
(3)取最后几滴洗出液加入稀盐酸,若无浑浊现象,说明沉淀已洗净(3分)
(4)低温洪干(2分)
(5)合格(2分)
20.(9分) 解析:设需加入VmL 2mol/L的盐酸
混合液中溶质的总物质的量
![]()
混合溶液的总体积:
![]()
混合液的物质的量浓度:
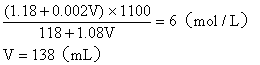
计算正确5分,简答正确4分。